Проекцийн томъёо. Фишерийн төсөөллийн томьёо. Харьцангуй D- ба L нь стереохимийн нэршлийн систем юм. Стереоизомеруудын үнэмлэхүй тохиргоо. Бусад төрлийн оптик идэвхтэй бодисууд
ХАМТОрганик нэгдлүүдийн дунд гэрлийн туйлшралын хавтгайг эргүүлэх чадвартай бодисууд байдаг. Энэ үзэгдлийг оптик идэвхжил гэж нэрлэдэг бөгөөд холбогдох бодисууд нь байдаг оптик идэвхтэй. Оптик идэвхтэй бодисууд нь хосоороо тохиолддог оптик антиподууд- нэг зүйлийг эс тооцвол ердийн нөхцөлд физик, химийн шинж чанар нь ижил байдаг изомерууд - туйлшралын хавтгайг эргүүлэх тэмдэг: оптик антиподуудын нэг нь туйлшралын хавтгайг баруун тийш хазайдаг (+, dextrorotatory изомер), нөгөө нь зүүн талд (-, levorotatory).
Молекул агуулсан үед оптик изомеризм гарч ирдэг тэгш бус нүүрстөрөгчийн атом. Энэ нь дөрвөн өөр орлуулагчтай холбогдсон нүүрстөрөгчийн атомыг нэрлэсэн нэр юм. Тэгш бус атомын эргэн тойронд орлуулагчдын хоёр тетраэдр зохион байгуулалт боломжтой. Орон зайн хэлбэрийг хоёуланг нь ямар ч эргэлтээр нэгтгэх боломжгүй; тэдгээрийн нэг нь нөгөөгийнхөө толин тусгал дүрс юм.
Изомеризмын төрлийг харгалзан үздэг оптик изомеризм
, толин тусгал изомеризм
эсвэл энантиомеризм
. Хоёр толин тусгал хэлбэр нь хос оптик антипод үүсгэдэг энантиомерууд
.
Орон зайн изомеруудын тоог Фишерийн томъёогоор тодорхойлно N = 2 n, энд n нь тэгш бус төвүүдийн тоо юм.
Проекцийн томъёо
Хавтгай дээрх тэгш бус атомыг ердийн байдлаар дүрслэхийн тулд ашиглана уу Э.Фишерийн төсөөллийн томьёо. Тэдгээрийг тэгш хэмт бус атомтай холбоотой атомуудыг хавтгайд тусгах замаар олж авдаг. Энэ тохиолдолд тэгш хэмт бус атомыг ихэвчлэн орхигдуулдаг бөгөөд зөвхөн огтлолцсон шугамууд болон орлуулагч тэмдгүүдийг хадгалдаг. Орлуулагчдын орон зайн зохион байгуулалтыг санахын тулд проекцын томъёонд эвдэрсэн босоо шугамыг ихэвчлэн хадгалдаг (дээд ба доод орлуулагчдыг зургийн хавтгайгаас гадуур арилгадаг), гэхдээ энэ нь ихэвчлэн хийгддэггүй. Өмнөх зураг дээрх зүүн загварт тохирох проекцын томъёог бичих өөр өөр аргуудыг доор харуулав.

Проекцийн томъёоны зарим жишээ энд байна:

Бодисын нэрс нь тэдний эргэлтийн шинж тэмдгийг харуулдаг. Энэ нь жишээлбэл, бутанол-2-ийн зүүн гар талын антипод нь дээрх томьёогоор тодорхой илэрхийлэгдсэн орон зайн тохиргоотой бөгөөд толин тусгал дүрс нь баруун гарын бутанол-2-той тохирч байна гэсэн үг юм. Оптик антиподын тохиргоог туршилтаар тодорхойлно.
Хоёр антиподын ижил хэмжээтэй хольцыг нэрлэдэг уралдааны нөхөр. Энэ нь оптик идэвхгүй бөгөөд физик тогтмолуудын маш сайн утгыг агуулдаг.
Зарчмын хувьд оптик антипод бүрийг арван хоёр (!) өөр проекцийн томъёогоор дүрсэлж болно - проекцийг бүтээхдээ загвар хэрхэн байрлаж байгаа, аль талаас нь харж байгаагаас хамаарна. Төсөөллийн томъёог стандартчилахын тулд тэдгээрийг бичих тодорхой дүрмийг нэвтрүүлсэн. Тиймээс, үндсэн функц нь гинжний төгсгөлд байвал ихэвчлэн дээд хэсэгт байрладаг бол гол гинжийг босоо байдлаар дүрсэлсэн байдаг.
Проекцийн томъёог хөрвүүлэх дүрэм:
1. Томъёог стереохимийн утгыг өөрчлөхгүйгээр зургийн хавтгайд 180° эргүүлэх боломжтой.

2. Нэг тэгш бус атом дээрх орлуулагчдын хоёр (эсвэл тэгш тоо) дахин зохион байгуулалт нь томъёоны стереохимийн утгыг өөрчлөхгүй.

3. Тэгш бус төв дэх орлуулагчдын нэг (эсвэл ямар нэгэн сондгой тоо) солигдох нь оптик антиподын томъёонд хүргэдэг.

4. Зургийн хавтгайд 90 ° эргүүлэх нь томьёог эсрэгпод болгон хувиргах бөгөөд хэрэв тэр үед зургийн хавтгайтай харьцуулахад орлуулагчдын байршлын нөхцөл өөрчлөгдөөгүй бол өөрөөр хэлбэл. Одоо хажуугийн орлуулагчид нь зургийн хавтгайн ард, дээд ба доод хэсгүүд нь урд талд байрладаг гэж бүү бодоорой. Хэрэв та тасархай шугамтай томъёо ашигладаг бол тасархай шугамын өөрчилсөн чиглэл нь танд үүнийг шууд сануулах болно.

5. Сэлгээний оронд проекцийн томьёог дурын гурван орлуулагчийг цагийн зүүний дагуу эсвэл цагийн зүүний эсрэг эргүүлэх замаар өөрчилж болно; дөрөв дэх орлуулагч нь байрлалаа өөрчлөхгүй (энэ үйлдэл нь хоёр дахин зохион байгуулалттай тэнцэнэ):

6. Зургийн хавтгайгаас проекцын томьёо гаргаж болохгүй.
Бусад төрлийн оптик идэвхтэй бодисууд
Энэ хэсэгт оптик идэвхжил (жишээ нь, хос оптик антипод хэлбэрээр байдаг) органик нэгдлүүдийн бусад ангилалыг жагсаасан болно.
Нүүрстөрөгчийн атом нь органик нэгдлүүдийн молекулуудад хирал төвүүдийг бий болгох монополь эрх мэдэлтэй байдаггүй. Дөрөвдөгч аммонийн давс, гуравдагч амин исэлд агуулагдах цахиур, цагаан тугалга, тетраковалент азотын атомууд мөн хиралийн төв байж болно.

Эдгээр нэгдлүүдийн хувьд тэгш бус байдлын төв нь тэгш бус нүүрстөрөгчийн атом шиг тетраэдр бүтэцтэй байдаг. Гэсэн хэдий ч хирал төвийн өөр өөр орон зайн бүтэцтэй нэгдлүүд бас байдаг.
пирамидУг тохиргоо нь гурвалсан азот, фосфор, хүнцэл, сурьма, хүхрийн атомуудаас бүрдсэн хирал төвүүд юм. Зарчмын хувьд гетероатомын дан электрон хосыг дөрөв дэх орлуулагчаар авбал тэгш бус байдлын төвийг тетраэдр гэж үзэж болно.

Оптик идэвхжил ч тохиолдож болно гүйгээр бүхэл бүтэн молекулын бүтцийн хираль байдлаас шалтгаалан хирал төв ( молекулын хирализм эсвэл молекулын тэгш бус байдал ). Хамгийн ердийн жишээ бол оршихуй юм хираль тэнхлэг эсвэл хираль хавтгай .
Хирал тэнхлэг нь жишээлбэл, янз бүрийн орлуулагч агуулсан алленуудад илэрдэг sp 2- эрлийз нүүрстөрөгчийн атомууд. Доорх нэгдлүүд нь тохирохгүй толин тусгал дүрс, тиймээс оптик антиподууд болохыг харахад хялбар байдаг.

Хирал тэнхлэгтэй өөр нэг ангиллын нэгдлүүд нь оптик идэвхтэй бифенилүүд юм орто-байрлалууд нь бензолын цагирагуудыг холбосон С-С бондын эргэн тойронд чөлөөт эргэлтэнд саад болох их хэмжээний орлуулагчтай:

Хирал онгоцЭнэ нь "дээд" ба "доод", мөн "баруун" ба "зүүн" талуудын хооронд ялгагдах боломжтой гэдгээрээ онцлог юм. Хирал хавтгайтай нэгдлүүдийн жишээ бол оптик идэвхтэй бодис юм транс-циклоотен ба оптик идэвхтэй ферроцений дериватив:

Диастереомеризм
Хэд хэдэн тэгш бус атом бүхий нэгдлүүд нь нэг тэгш бус төвтэй, өмнө нь авч үзсэн энгийн оптик идэвхтэй бодисуудаас ялгах чухал шинж чанартай байдаг.
Тодорхой бодисын молекулд хоёр тэгш бус атом байдаг гэж үзье; Бид тэдгээрийг нөхцөлт байдлаар A ба B гэж тэмдэглэе. Дараах хослол бүхий молекулууд боломжтой болохыг харахад хялбар байдаг (N = 2 2 = 4):
1 ба 2-р молекулууд нь хос оптик антипод юм; 3 ба 4-р хос молекулуудад мөн адил хамаарна. Хэрэв бид өөр өөр хос антиподын молекулуудыг - 1 ба 3, 1 ба 4, 2 ба 3, 2 ба 4 -ийг өөр хоорондоо харьцуулж үзвэл жагсаасан хосууд харагдах болно. оптик антипод биш: нэг тэгш бус атомын тохиргоо ижил, нөгөөгийнх нь тохиргоо ижил биш байна. Эдгээр нь хосууд юм диастереомерууд , өөрөөр хэлбэл орон зайн изомерууд, Үгүй бие биетэйгээ оптик антиподуудыг бүрдүүлдэг.
Диастереомерууд нь бие биенээсээ зөвхөн оптик эргэлтээр төдийгүй бусад бүх физик тогтмолуудаараа ялгаатай байдаг: өөр өөр хайлах болон буцалгах цэгүүд, өөр өөр уусах чадвар гэх мэт Диастереомеруудын шинж чанаруудын ялгаа нь бүтцийн изомеруудын шинж чанарын ялгаанаас багагүй байдаг. .
Энэ төрлийн нэгдлүүдийн жишээ нь хлоромын хүчил (2 өөр хирал төв) байж болно.

Түүний стереоизомер хэлбэрүүд нь дараах төсөөллийн томьёотой байна.

| эритро хэлбэрүүд | трео хэлбэрүүд |
Гарчиг эритро- Тэгээд гурвалсан- эритроз ба триоз гэсэн нүүрс усны нэрнээс гаралтай. Эдгээр нэрсийг хоёр тэгш бус атомтай нэгдлүүдийн орлуулагчдын харьцангуй байрлалыг зааж өгөхөд ашигладаг. эритро -изомерууд нь нэг талдаа (баруун эсвэл зүүн, Е үсгийн хоёр төгсгөл) стандарт проекцын томъёонд хоёр ижил хажуугийн орлуулагч гарч ирдэг; гурвалсан -изомерууд проекцын томъёоны өөр өөр тал дээр ижил хажуугийн орлуулагчтай байдаг. Хоёр эритро-изомерууд нь хос оптик антиподууд бөгөөд тэдгээрийг холиход рацемат үүсдэг. Хос оптик изомерууд нь ба гурван-хэлбэрүүд; мөн тэдгээр нь холилдсон үед ракемат үүсгэдэг бөгөөд энэ нь ракематаас шинж чанараараа ялгаатай эритро-хэлбэрүүд. Тиймээс хлоромалийн хүчлийн нийт дөрвөн оптик идэвхтэй изомер ба хоёр рацемат байдаг.
Зарим бүтэц дэх хэсэгчилсэн тэгш хэмийн улмаас стереоизомеруудын тоо буурч болно. Үүний нэг жишээ бол дарсны хүчил бөгөөд бие даасан стереоизомеруудын тоо гурав хүртэл буурдаг. Тэдний төсөөллийн томъёо:

| I | Ia | II | III |
Формула I нь зургийн хавтгайд 180° эргүүлэх үед түүнд хувирдаг тул шинэ стереоизомерыг төлөөлөхгүй тул Ia томьёотой ижил байна. Энэ оптик идэвхгүй өөрчлөлтийг гэж нэрлэдэг мезо хэлбэр . Бүх оптик идэвхтэй бодисууд нь хэд хэдэн ижил (жишээ нь, ижил орлуулагчтай холбоотой) тэгш бус төвүүдтэй мезо хэлбэртэй байдаг. Мезо хэлбэрийн проекцын томьёо нь тэдгээрийг хэвтээ шугамаар хоёр хагас болгон хувааж болох бөгөөд цаасан дээр бичсэнээр албан ёсоор ижил боловч бодит байдал дээр толин тусгал (дотоод тэгш хэмийн хавтгай) байдаг тул үргэлж хүлээн зөвшөөрч болно.

II ба III томъёо нь дарсны хүчлийн оптик антиподуудыг дүрсэлсэн; тэдгээрийг холих үед оптик идэвхгүй ракемат үүсдэг - усан үзмийн хүчил.
Оптик изомеруудын нэршил
Хамгийн энгийн, хамгийн эртний, гэхдээ одоо ч ашиглагдаж байгаа оптик антиподын нэр томъёо нь "түлхүүр" болгон сонгосон тодорхой стандарт бодисын проекцын томьёотой гэж нэрлэгддэг антиподын проекцын томъёог харьцуулах үндсэн дээр суурилдаг. Тиймээс α-гидрокси хүчил ба α-амин хүчлүүдийн хувьд гол нь тэдгээрийн проекцын томьёоны дээд хэсэг (стандарт тэмдэглэгээнд):

Стандарт бичигдсэн Фишерийн төсөөллийн томьёоны зүүн талд гидроксил бүлэгтэй бүх α-гидрокси хүчлүүдийн тохиргоог тэмдгээр тэмдэглэв. Л; хэрэв гидроксил баруун талд проекцын томъёонд байрласан бол тэмдэг Д
Нэгдлүүдийн тохиргоог тодорхойлох түлхүүр нь глицеральдегид юм.

Элсэн чихрийн молекул дахь тэмдэглэгээ D-эсвэл L-тохиргоонд хамаарна доогууртэгш бус төв.
Систем D-,L-тэмдэглэгээ нь мэдэгдэхүйц сул талуудтай: нэгдүгээрт, тэмдэглэгээ D-эсвэл L-Энэ нь зөвхөн нэг тэгш бус атомын тохиргоог илэрхийлдэг; хоёрдугаарт, зарим нэгдлүүдийн хувьд глицеральдегид эсвэл гидрокси хүчлийн түлхүүрийг түлхүүр болгон авсан эсэхээс хамааран өөр өөр тэмдэглэгээг авдаг, жишээлбэл:

Түлхүүр системийн эдгээр дутагдал нь одоогоор түүний хэрэглээг элсэн чихэр, амин хүчил, гидрокси хүчил гэсэн гурван төрлийн оптик идэвхтэй бодисоор хязгаарлаж байна. Ерөнхий хэрэглээнд зориулагдсан R, S-систем Кан, Инголд, Прелог нар.
Оптик антиподын R- эсвэл S-тохиргоог тодорхойлохын тулд тэгш бус нүүрстөрөгчийн атомын эргэн тойронд орлуулагчдын тетраэдрийг хамгийн бага орлуулагч (ихэвчлэн устөрөгч) нь "ажиглагчаас хол" байхаар байрлуулах шаардлагатай. Шилжилтийн үеэр үлдсэн гурван орлогчийн тойрогт ахмадаас дунд, дараа нь хамгийн залуу руу шилжих хөдөлгөөн үүсвэл цагийн зүүний эсрэг - Энэ С -изомер (S үсгийг бичихэд ижил гар хөдөлгөөнтэй холбоотой), хэрэв цагийн зүүний дагуу - Энэ R- изомер (R үсэг бичих үед гарны хөдөлгөөнтэй холбоотой).
Тэгш бус атом дээрх орлуулагчдын насыг тодорхойлохын тулд атомын дугаарыг тооцоолох дүрмийг ашигладаг бөгөөд үүнийг геометрийн изомеруудын Z, E нэршилтэй холбогдуулан аль хэдийн хэлэлцсэн болно.
Проекцийн томъёоны дагуу R, S тэмдэглэгээг сонгохын тулд тэгш тоогоор (бидний мэдэж байгаагаар томъёоны стереохимийн утгыг өөрчилдөггүй) орлуулагчдыг хамгийн залуу нь байхаар байрлуулах шаардлагатай. тэдгээр нь (ихэвчлэн устөрөгч) проекцын томъёоны доод хэсэгт байдаг. Дараа нь цагийн зүүний дагуу унасан үлдсэн гурван орлуулагчийн нас нь R тэмдэглэгээтэй, цагийн зүүний эсрэг - S тэмдэглэгээтэй тохирч байна.

Органик нэгдлүүдийн бүтцийн талаархи орчин үеийн санаанууд. Органик нэгдлүүдийн стереохимийн үндэс. Асимметрик нүүрстөрөгчийн атом. Хирализм. Фишерийн төсөөллийн томьёо.
Химийн бүтцийн онол A.M. Бутлеров
1861 онд МЭ. Бутлеров органик нэгдлүүдийн химийн бүтцийн онолыг санал болгосон бөгөөд энэ нь дараах үндсэн зарчмуудаас бүрддэг.
1) Бодисын молекулуудад атомуудын химийн холболтын хатуу дараалал байдаг бөгөөд үүнийг химийн бүтэц гэж нэрлэдэг.
2) Бодисын химийн шинж чанар нь түүний үндсэн бүрэлдэхүүн хэсгүүдийн шинж чанар, тэдгээрийн тоо хэмжээ, химийн бүтцээр тодорхойлогддог.
3) Ижил найрлага, молекул жинтэй бодисууд өөр өөр бүтэцтэй бол изомеризмын үзэгдэл үүсдэг.
4) Тодорхой урвалын үед молекулын зөвхөн зарим хэсэг нь өөрчлөгддөг тул бүтээгдэхүүний бүтцийг судлах нь анхны молекулын бүтцийг тодорхойлоход тусалдаг.
5) Молекул дахь бие даасан атомуудын химийн шинж чанар (реактив) нь хүрээлэн буй орчноос хамааран өөрчлөгддөг, i.e. бусад элементүүдийн аль атомуудтай холбогдож байгаагаас хамаарна.
Бутлеровын онол нь химийн шинж чанаруудын (макроскоп шинж чанаруудын) мэдлэгээр дамжуулан молекулын геометрийг (микроскоп шинж чанар) мэдэх үндсэн боломжийг олгодог. Бүтцийн онолын үндсэн зарчмууд өнөөг хүртэл ач холбогдлоо хадгалсаар байна.
Химийн холболтын цахим онолууд.
Органик нэгдлүүдийн электрон бүтцийг Льюисийн электрон томъёогоор дүрсэлсэн. Тэд цэгүүдийг ашиглан бүх валентийн электронуудын байрлалыг заадаг: химийн бондын электронууд ба ганц хос электронууд. Ганц хос электронууд нь зөвхөн нэг атомын гадна бүрхүүлийн нэг хэсэг бөгөөд ковалент холбоо үүсэхэд оролцдог электронууд нь хоёр атомын гаднах бүрхүүлийн нэг хэсэг гэж үздэг. Жишээлбэл, доорх нүүрстөрөгчийн тетрахлоридын Льюисийн томъёонд бүх атомууд октет электронтой байдаг.
Льюисийн бүтэц дэх атом бүрийн хувьд албан ёсны цэнэгийг тодорхойлно. Атом нь ковалент холбоонд хуваагдаагүй бүх электрон болон хагас электроныг эзэмшдэг гэж үздэг.Молекул дахь атомд хамаарах электронууд чөлөөт атомтай харьцуулахад илүүдэл нь сөрөг цэнэг үүсгэдэг ба дутагдал нь эерэг цэнэг үүсгэдэг. Бүх атомын албан ёсны цэнэгийн нийлбэр нь бөөмийн цэнэгийг бүхэлд нь өгдөг.

Квант органик химийн үндсэн зарчмууд.

Ковалентын бондын орчин үеийн онолууд нь квант механикийн үзэл баримтлалд суурилдаг. Квант механикийн зарчмын дагуу атом дахь электроны төлөвийг атомын орбитал гэж нэрлэгддэг долгионы функцээр тодорхойлдог. Атомуудын хооронд химийн холбоо үүсэх нь тус бүр нь нэг электрон агуулсан хоёр орбитал харилцан үйлчлэлийн үр дүн гэж үздэг. Энэ тохиолдолд молекулын тойрог зам (MOs) үүсдэг. Хоёр атомын орбиталаас хоёр молекул орбитал үүсдэг бөгөөд тэдгээрийн нэг нь ( холбох) бага энергитэй, нөгөө нь ( сулрах) – анхны АО-оос өндөр энерги.
Бондын электронууд нь доод энергийн холболтын тойрог замыг эзэлдэг тул орбиталуудын харилцан үйлчлэлийн үр дүнд энерги нэмэгдэх болно.

Нэгдэж буй атомын орбиталуудын төрлөөс хамааран өөр өөр төрлийн MO үүсдэг. Үүнд орбиталуудын тэгш хэм, зангилааны шинж чанарууд шийдвэрлэх үүрэг гүйцэтгэдэг. Атомс -орбиталууд нь бөмбөрцөг тэгш хэмтэй бөгөөд атомын төвөөр дамждаг зангилааны гадаргуугүй байдаг. Атомх -Орбиталууд нь цилиндр тэгш хэмтэй, гурван төлөвтэй байдаг p x , p y ба p z . p бүр Орбитал нь атомын төвийг дайран өнгөрч, тэнхлэгт перпендикуляр байдаг зангилааны хавтгайтай. x, y эсвэл z.
Зангилааны гадаргуу нь электрон олох магадлал 0, долгионы функц тэмдэг өөрчлөгддөг газар юм. Зангилаа их байх тусам тойрог замын энерги өндөр болно. Тиймээс,х -Орбитал нь долгионы функцүүдийн шинж тэмдгүүд нь эсрэг байдаг хоёр хэсгээс бүрдэнэ.
Полиатом молекулуудын электрон бүтцийг авч үзэхдээ тэдгээрийн хамгийн их давхцалд хүрэх орбиталуудын багцыг ашиглах шаардлагатай. Үүнтэй холбоотойгоор нэг ойлголт бий эрлийзжүүлэх тойрог замууд. Өдөөгдсөн төлөвт байгаа нүүрстөрөгчийн атом нь гаднах энергийн түвшинд дөрвөн хосгүй электрон агуулдаг бөгөөд дөрвөн ковалент холбоо үүсгэх чадвартай.
Эрлийз тойрог замууд нь холбоо үүсгэхэд оролцдог.
Эхний валент төлөв нь sp 3 эрлийзжилт юм . Нүүрстөрөгчийн атомын нэг s ба гурван p орбиталын оролцоотой эрлийзжүүлсний үр дүнд 109.5 o өнцгөөр тетраэдрийн орой руу чиглэсэн дөрвөн эквивалент sp 3 - эрлийз орбитал үүсдэг.
sp 3 эрлийзжих төлөвт нүүрстөрөгчийн атом дөрвийг үүсгэдэгс-дөрвөн орлуулагчтай холбогддог ба 109.5 o-тэй тэнцүү буюу ойролцоо өнцгөөр тетраэдр хэлбэртэй:

Метан
Хоёр дахь валентын төлөв нь sp 2 эрлийзжилт юм . Нүүрстөрөгчийн атомын нэг s- ба хоёр p-орбиталийн оролцоотой эрлийзжүүлсний үр дүнд гурван эквивалент sp 2 - эрлийз орбиталь үүсдэг бөгөөд нэг хавтгайд 120 o өнцгөөр хэвтэж, p-орбитал оролцохгүй. гибридизацийн хувьд эрлийз тойрог замын хавтгайд перпендикуляр байрладаг.
Sp 2 эрлийзжих төлөвт нүүрстөрөгчийн атом нь гурвыг үүсгэдэгс-эрлийз орбиталаас үүдэлтэй бонд ба нэгх-эрлийзжихэд p-орбитал оролцохгүйн улмаас үүссэн холбоо ба гурван орлуулагчтай.
Нүүрстөрөгчийн гурав дахь валент байдал нь sp-эрлийзжилт юм . Нэг s- ба нэг p-орбиталын оролцоотой эрлийзжүүлсний үр дүнд 180 0 өнцгөөр байрлах хоёр эквивалент sp-эрлийз орбитал үүсч, эрлийзжихэд оролцдоггүй p-орбиталууд хавтгайд перпендикуляр байрладаг. эрлийз орбиталуудын болон өөр хоорондоо. Sp-гибридизацийн төлөвт нүүрстөрөгчийн атом нь хоёрыг үүсгэдэгс-эрлийз орбиталаас үүдэлтэй бонд ба хоёрх-эрлийзжихэд оролцдоггүй p-орбиталуудын улмаас үүссэн холбоо ба хоёр орлуулагчтай:

Ацетилен
Стереохимийн үндэс.
Стереохими нь молекулуудын орон зайн бүтэц, энэ бүтэц нь бодисын физик, химийн шинж чанар, тэдгээрийн урвалын чиглэл, хурдад үзүүлэх нөлөөг судлахад зориулагдсан химийн нэг хэсэг юм.
Конформаци (эргэлтийн изомеризм).
Хамгийн энгийн органик нүүрсустөрөгч болох метанаас хамгийн ойр гомолог болох этан руу шилжих нь орон зайн бүтцийн асуудал үүсгэдэг бөгөөд үүнийг шийдвэрлэхийн тулд өмнө нь авч үзсэн параметрүүдийг мэдэх нь хангалтгүй юм. Бондын өнцөг болон уртыг өөрчлөхгүйгээр этан молекулын олон геометрийн хэлбэрийг төсөөлж болно, тэдгээр нь нүүрстөрөгчийн тетраэдрүүдийг холбосон C-C бондын эргэн тойронд харилцан эргэдэгээрээ бие биенээсээ ялгаатай. Энэхүү эргэлтийн үр дүнд эргэлтэт изомерууд (конформерууд) . Янз бүрийн конформеруудын энерги нь ижил биш боловч янз бүрийн эргэлтэт изомеруудыг тусгаарлах энергийн саад нь ихэнх органик нэгдлүүдийн хувьд бага байдаг. Тиймээс, ердийн нөхцөлд, дүрмээр бол молекулуудыг нэг хатуу тодорхойлсон конформацид засах боломжгүй юм. Ихэвчлэн бие биедээ амархан хувирдаг хэд хэдэн эргэлтийн хэлбэрүүд тэнцвэрт байдалд зэрэгцэн оршдог.
Конформац, тэдгээрийн нэршлийг графикаар илэрхийлэх аргуудыг авч үзье. Этан молекулын хувьд энергийн хувьд хамгийн их ялгаатай хоёр конформаци байгааг урьдчилан таамаглах боломжтой. Тэдгээрийг доор харуулав хэтийн төлөвийн төсөөлөл (1) (“хөрөөний ямаа”), хажуугийн төсөөлөл (2) ба Ньюманы томъёо .

Зүүн талд харуулсан конформацийг дуудна бүрхэгдсэн . Энэ нэр нь CH 3 бүлгийн устөрөгчийн атомууд бие биенийхээ эсрэг байгааг сануулж байна. хиртэгдсэн конформаци нь дотоод энергийг ихэсгэсэн тул тааламжгүй байдаг. Баруун талд үзүүлсэн конформацийг дуудна саатуулсан , энэ байрлалд С-С бондын эргэн тойрон дахь чөлөөт эргэлтийг "дарангуйлсан" гэсэн үг, өөрөөр хэлбэл. молекул нь энэ хэлбэрт голчлон оршдог.
Молекул илүү төвөгтэй болохын хэрээр боломжит конформацийн тоо нэмэгддэг. Тийм ээ, төлөө n-бутаныг аль хэдийн CH 3 бүлгүүдийн харьцангуй зохион байгуулалтаар ялгаатай зургаан хэлбэрт дүрсэлж болно, өөрөөр хэлбэл. төвийн холболтын эргэн тойронд эргэлт C-C. Доор n-бутаны конформацийг Ньюманы төсөөлөл хэлбэрээр дүрсэлсэн болно. Зүүн талд (сүүдэрт) харуулсан хэлбэрүүд нь эрчим хүчний хувьд тааламжгүй, зөвхөн дарангуйлагдсан хэлбэрүүд нь бараг хэрэгждэг.

Бутаны янз бүрийн хиртсэн болон дарангуйлагдсан конформаци нь энергийн хувьд ижил биш юм. Төв С-С бондын эргэн тойронд эргэлт хийх явцад үүссэн бүх конформацийн харгалзах энерги.
Тиймээс конформаци нь тодорхой тохиргоотой молекулын орон зайн өөр өөр хэлбэрүүд юм. Конформерууд нь боломжит энергийн диаграмм дээрх энергийн минимумтай тохирч, хөдөлгөөнт тэнцвэрт байдалд байгаа, энгийн бондын эргэн тойронд эргүүлэх замаар харилцан хувирах чадвартай стереоизомер бүтэц юм.
Заримдаа ийм өөрчлөлтийн саад бэрхшээл нь стереоизомер хэлбэрийг (жишээлбэл, оптик идэвхтэй бифенил) салгахад хангалттай өндөр болдог. Ийм тохиолдолд тэд конформеруудын тухай ярихаа больсон, харин үнэндээ байгаа тухай ярьдаг стереоизомерууд .
Геометрийн изомеризм.
Давхар бондын хатуу байдлын чухал үр дагавар (түүний эргэн тойронд эргэлт байхгүй) оршин тогтнох явдал юм. геометрийн изомерууд . Тэдгээрийн хамгийн түгээмэл нь cis-, транс-изомерууд ханаагүй атомууд дээр тэгш бус орлуулагч агуулсан этилен цувралын нэгдлүүд. Хамгийн энгийн жишээ бол бутен-2-ийн изомерууд юм.

Геометрийн изомерууд нь ижил химийн бүтэцтэй, атомуудын орон зайн зохион байгуулалтаар ялгаатай, өөрөөр хэлбэл. By тохиргоо . Энэ ялгаа нь физик (түүнчлэн химийн) шинж чанарын ялгааг бий болгодог. Геометрийн изомерууд нь конформеруудаас ялгаатай нь цэвэр хэлбэрээр тусгаарлагдаж, бие даасан тогтвортой бодис хэлбэрээр оршдог. Тэдний харилцан хувиргалтын хувьд 125-170 кЖ/моль эрчим хүч шаардагддаг бөгөөд үүнийг халаах эсвэл цацрагаар хангах боломжтой.
Хамгийн энгийн тохиолдолд геометрийн изомеруудын нэршил нь ямар ч хүндрэл учруулдаггүй. cis- хэлбэрүүд нь геометрийн изомерууд бөгөөд тэдгээрт ижил орлуулагчид пи бондын хавтгайн нэг талд оршдог. транс- изомерууд пи бондын хавтгайн өөр өөр тал дээр ижил орлуулагчтай байдаг. Илүү төвөгтэй тохиолдолд үүнийг ашигладаг Z,E-номенклатур . Үүний гол зарчим: тохиргоог зааж өгөх cis-(З, Германы Зусамменаас - хамтдаа) эсвэл транс-(E, Германы Энтгегенээс - эсрэг талд) байршил ахлах орлогч нар давхар бондтой.
Z,E системд илүү өндөр атомын дугаартай орлуулагчдыг ахмад гэж үздэг. Хэрэв ханаагүй нүүрстөрөгчтэй шууд холбоотой атомууд ижил байвал тэд "хоёр дахь давхарга", шаардлагатай бол "гурав дахь давхарга" руу шилждэг.
3. Оптик изомеризм (энантиомеризм).
Органик нэгдлүүдийн дунд гэрлийн туйлшралын хавтгайг эргүүлэх чадвартай бодисууд байдаг. Энэ үзэгдлийг оптик идэвхжил гэж нэрлэдэг ба холбогдох бодисуудыг нэрлэдэг оптик идэвхтэй . Оптик идэвхтэй бодисууд нь хосоороо тохиолддог оптик антиподууд - изомерууд, ердийн нөхцөлд физик, химийн шинж чанар нь ижил байдаг, нэг зүйлийг эс тооцвол - туйлшралын хавтгайн эргэлтийн тэмдэг. (Хэрэв оптик антиподуудын аль нэг нь жишээлбэл +20 o эргэлттэй бол нөгөө нь -20 o эргэлттэй байна).
Проекцийн томъёо.
Хавтгай дээрх тэгш бус атомыг ердийн байдлаар дүрслэхийн тулд ашиглана уу Э.Фишерийн төсөөллийн томьёо . Тэдгээрийг тэгш хэмт бус атомтай холбоотой атомуудыг хавтгайд тусгах замаар олж авдаг. Энэ тохиолдолд тэгш хэмт бус атомыг ихэвчлэн орхигдуулдаг бөгөөд зөвхөн огтлолцсон шугамууд болон орлуулагч тэмдгүүдийг хадгалдаг. Орлуулагчдын орон зайн зохион байгуулалтыг санахын тулд проекцын томъёонд эвдэрсэн босоо шугамыг ихэвчлэн хадгалдаг (дээд ба доод орлуулагчдыг зургийн хавтгайгаас гадуур арилгадаг), гэхдээ энэ нь ихэвчлэн хийгддэггүй. өмнөх зураг дээрх зүүн загвар:

Проекцийн томъёоны зарим жишээ энд байна:
(+)-аланин(-)2-бутанол(+)-глицеральдегид
Бодисын нэрс нь тэдний эргэлтийн шинж тэмдгийг харуулдаг. Энэ нь жишээлбэл, бутанол-2-ийн зүүн гар талын антипод байдаг гэсэн үг юм орон зайн тохиргоо, дээрх томьёогоор нарийн илэрхийлсэн бөгөөд түүний толин тусгал дүрс нь декстроротатор бутанол-2-той тохирч байна. Тохиргооны тодорхойлолтоптик антиподуудыг туршилтаар хийдэг.
Зарчмын хувьд оптик антипод бүрийг арван хоёр (!) өөр проекцийн томъёогоор дүрсэлж болно - проекцийг бүтээхдээ загвар хэрхэн байрлаж байгаа, аль талаас нь харж байгаагаас хамаарна. Төсөөллийн томъёог стандартчилахын тулд тэдгээрийг бичих тодорхой дүрмийг нэвтрүүлсэн. Тиймээс, үндсэн функц нь гинжний төгсгөлд байвал ихэвчлэн дээд хэсэгт байрладаг бол гол гинжийг босоо байдлаар дүрсэлсэн байдаг.
“Стандарт бус” бичмэл проекцын томьёог харьцуулахын тулд проекцын томьёог хувиргах дараах дүрмийг мэдэх шаардлагатай.“Стандарт бус” бичмэл проекцын томьёог харьцуулахын тулд проекцын томьёог хувиргах дараах дүрмийг мэдэж байх шаардлагатай.


1. Томъёог стереохимийн утгыг өөрчлөхгүйгээр зургийн хавтгайд 180° эргүүлэх боломжтой.

2. Нэг тэгш бус атом дээрх орлуулагчдын хоёр (эсвэл тэгш тоо) дахин зохион байгуулалт нь томъёоны стереохимийн утгыг өөрчлөхгүй.

3. Тэгш бус төв дэх орлуулагчдын нэг (эсвэл ямар нэгэн сондгой тоо) солигдох нь оптик антиподын томъёонд хүргэдэг.

4. Зургийн хавтгайд 90 ° эргүүлэх нь томьёог эсрэг байрлал болгон хувиргадаг, хэрэв тэр үед зургийн хавтгайтай харьцуулахад орлуулагчдын байршлын нөхцөл өөрчлөгдөөгүй бол өөрөөр хэлбэл. Одоо хажуугийн орлуулагчид нь зургийн хавтгайн ард, дээд ба доод хэсгүүд нь урд талд байрладаг гэж бүү бодоорой. Хэрэв та тасархай шугамтай томъёо ашигладаг бол тасархай шугамын өөрчилсөн чиглэл нь танд үүнийг шууд сануулах болно.
5. Сэлгээний оронд проекцийн томьёог дурын гурван орлуулагчийг цагийн зүүний дагуу эсвэл цагийн зүүний эсрэг эргүүлэх замаар өөрчилж болно; дөрөв дэх орлуулагч нь байрлалаа өөрчлөхгүй (энэ үйлдэл нь хоёр дахин зохион байгуулалттай тэнцэнэ):

6. Зургийн хавтгайгаас проекцын томьёо гаргаж болохгүй.
Уралдааны нөхөд.
Хэрэв бодисын томьёо нь тэгш бус атом агуулдаг бол энэ нь ийм бодис оптик идэвхжилтэй болно гэсэн үг биш юм. Хэрэв хэвийн урвалын үед тэгш хэмт бус төв үүсвэл (CH 2 бүлэгт орлуулах, давхар бондын нэмэлт гэх мэт) антиподеаны тохиргоог хоёуланг нь үүсгэх магадлал ижил байна. Тиймээс, бие даасан молекул бүрийн тэгш бус байдлыг үл харгалзан үүссэн бодис нь оптик идэвхгүй болж хувирдаг. Энэ төрлийн оптик идэвхгүй өөрчлөлтийг хоёуланг нь ижил хэмжээтэй антипод гэж нэрлэдэг уралдааны нөхөд.
Бусад төрлийн оптик идэвхтэй бодисууд.
Энэ хэсэгт оптик идэвхжил (жишээ нь, хос оптик антипод хэлбэрээр байдаг) органик нэгдлүүдийн бусад ангилалыг жагсаасан болно.

Нүүрстөрөгчийн атом нь органик нэгдлүүдийн молекулуудад хирал төвүүдийг бий болгох монополь эрх мэдэлтэй байдаггүй. Дөрөвдөгч аммонийн давс, гуравдагч амин исэлд агуулагдах цахиур, цагаан тугалга, тетраковалент азотын атомууд мөн хиралийн төв байж болно.
Эдгээр нэгдлүүдийн хувьд тэгш бус байдлын төв нь тэгш бус нүүрстөрөгчийн атом шиг тетраэдр бүтэцтэй байдаг. Гэсэн хэдий ч хирал төвийн өөр өөр орон зайн бүтэцтэй нэгдлүүд бас байдаг.

пирамид Уг тохиргоо нь гурвалсан азот, фосфор, хүнцэл, сурьма, хүхрийн атомуудаас бүрдсэн хирал төвүүд юм. Зарчмын хувьд гетероатомын дан электрон хосыг дөрөв дэх орлуулагчаар авбал тэгш бус байдлын төвийг тетраэдр гэж үзэж болно.
Оптик идэвхжил ч тохиолдож болно гүйгээр бүхэл бүтэн молекулын бүтцийн хираль байдлаас шалтгаалан хирал төв ( молекулын хирализм эсвэл молекулын тэгш бус байдал ). Хамгийн ердийн жишээ бол оршихуй юм хираль тэнхлэг эсвэл хираль хавтгай .

Хирал тэнхлэг нь жишээлбэл, янз бүрийн орлуулагч агуулсан алленуудад илэрдэг sp 2- эрлийз нүүрстөрөгчийн атомууд. Доорх нэгдлүүд нь тохирохгүй толин тусгал дүрс, тиймээс оптик антиподууд болохыг харахад хялбар байдаг.

Хирал тэнхлэгтэй өөр нэг ангиллын нэгдлүүд нь оптик идэвхтэй бифенилүүд юм орто-байрлалууд нь бензолын цагирагуудыг холбосон С-С бондын эргэн тойронд чөлөөт эргэлтэнд саад болох их хэмжээний орлуулагчтай:
Хирал онгоц Энэ нь "дээд" ба "доод", мөн "баруун" ба "зүүн" талуудын хооронд ялгагдах боломжтой гэдгээрээ онцлог юм. Хирал хавтгайтай нэгдлүүдийн жишээ бол оптик идэвхтэй бодис юм транс-циклоотен ба оптик идэвхтэй ферроцений дериватив:
Диастереомеризм.
Хэд хэдэн тэгш бус атом бүхий нэгдлүүд нь нэг тэгш бус төвтэй, өмнө нь авч үзсэн энгийн оптик идэвхтэй бодисуудаас ялгах чухал шинж чанартай байдаг.
Тодорхой бодисын молекулд хоёр тэгш бус атом байдаг гэж үзье; Тэдгээрийг болзолт A ба B гэж нэрлэе. Дараах хослол бүхий молекулууд боломжтой болохыг харахад хялбар байдаг.
|
((-) |
((-) |
((-) |
((+) |
||
|
Молекул 1 |
Ф А |
Молекул 3 |
АА |
Б.Б |
|
|
((+) |
((+) |
((+) |
((-) |
||
|
Молекул 2 |
АА |
Б.Б |
Молекул 4 |
АА |
Б.Б |
1 ба 2-р молекулууд нь хос оптик антипод юм; 3 ба 4-р хос молекулуудад мөн адил хамаарна. Хэрэв бид өөр өөр хос антиподын молекулуудыг - 1 ба 3, 1 ба 4, 2 ба 3, 2 ба 4 -ийг өөр хоорондоо харьцуулж үзвэл жагсаасан хосууд харагдах болно. оптик антипод биш: нэг тэгш бус атомын тохиргоо ижил, нөгөөгийнх нь тохиргоо ижил биш байна. Эдгээр нь хосууд юм диастереомерууд , өөрөөр хэлбэл орон зайн изомерууд, Үгүй бие биетэйгээ оптик антиподуудыг бүрдүүлдэг.
Диастереомерууд нь бие биенээсээ зөвхөн оптик эргэлтээр төдийгүй бусад бүх физик тогтмолуудаараа ялгаатай байдаг: өөр өөр хайлах болон буцалгах цэгүүд, өөр өөр уусах чадвар гэх мэт Диастереомеруудын шинж чанаруудын ялгаа нь бүтцийн изомеруудын шинж чанарын ялгаанаас багагүй байдаг. .

Энэ төрлийн нэгдлүүдийн жишээ бол хлоромалийн хүчил юм

Түүний стереоизомер хэлбэрүүд нь дараах төсөөллийн томьёотой байна.
эритро-хэлбэрүүд гурван-хэлбэрүүд
Гарчиг эритро- Тэгээд гурвалсан- эритроз ба триоз гэсэн нүүрс усны нэрнээс гаралтай. Эдгээр нэрсийг хоёр тэгш бус атомтай нэгдлүүдийн орлуулагчдын харьцангуй байрлалыг зааж өгөхөд ашигладаг. эритро - изомеруудЭдгээр нь нэг талдаа (баруун эсвэл зүүн) стандарт проекцын томъёонд хоёр ижил хажуугийн орлуулагч гарч ирдэг хүмүүс юм; гурвалсан - изомеруудпроекцын томъёоны өөр өөр тал дээр ижил хажуугийн орлуулагчтай байна. Хоёр эритро-изомерууд нь хос оптик антиподууд бөгөөд тэдгээрийг холиход рацемат үүсдэг. Хос оптик изомерууд нь ба гурван-хэлбэрүүд; мөн тэдгээр нь холилдсон үед ракемат үүсгэдэг бөгөөд энэ нь ракематаас шинж чанараараа ялгаатай эритро-хэлбэрүүд. Тиймээс хлоромалийн хүчлийн нийт дөрвөн оптик идэвхтэй изомер ба хоёр рацемат байдаг.
Тэгш бус төвүүдийн тоо цаашид нэмэгдэхийн хэрээр орон зайн изомеруудын тоо нэмэгдэж, шинэ тэгш бус төв бүр изомеруудын тоог хоёр дахин нэмэгдүүлнэ. Энэ нь 2 n томьёогоор тодорхойлогддог бөгөөд энд n нь тэгш бус төвүүдийн тоо юм.
Зарим бүтэц дэх хэсэгчилсэн тэгш хэмийн улмаас стереоизомеруудын тоо буурч болно. Үүний нэг жишээ бол дарсны хүчил бөгөөд бие даасан стереоизомеруудын тоо гурав хүртэл буурдаг. Тэдний төсөөллийн томъёо:

Формула I нь зургийн хавтгайд 180° эргүүлэх үед түүнд хувирдаг тул шинэ стереоизомерыг төлөөлөхгүй тул Ia томьёотой ижил байна. Энэ оптик идэвхгүй өөрчлөлтийг гэж нэрлэдэг мезо хэлбэр . Мезо-Бүх оптик идэвхтэй бодисууд нь хэд хэдэн ижил (жишээ нь, ижил орлуулагчтай холбоотой) тэгш бус төвүүдтэй хэлбэртэй байдаг. Проекцийн томъёо мезо-Маягтуудыг хэвтээ шугамаар хоёр хагас болгон хувааж, цаасан дээр бичихдээ албан ёсоор ижил боловч бодит байдал дээр толин тусгалтай байдаг тул үргэлж танигдаж болно.
II ба III томъёо нь дарсны хүчлийн оптик антиподуудыг дүрсэлсэн; тэдгээрийг холих үед оптик идэвхгүй ракемат үүсдэг - усан үзмийн хүчил.
Оптик изомеруудын нэршил.

Хамгийн энгийн, хамгийн эртний, гэхдээ одоо ч ашиглагдаж байгаа оптик антиподын нэр томъёо нь "түлхүүр" болгон сонгосон тодорхой стандарт бодисын проекцын томьёотой гэж нэрлэгддэг антиподын проекцын томъёог харьцуулах үндсэн дээр суурилдаг. Тийм ээ, төлөөа-гидрокси хүчил ба а-амин хүчлүүд, гол нь тэдний төсөөллийн томьёоны дээд хэсэг (стандарт тэмдэглэгээгээр):
L-гидрокси хүчил (X = OH) D-гидрокси хүчил (X = OH)
L-амин хүчил (X = NH 2) D-амин хүчил (X = NH 2)
Бүх тохиргооа-Стандарт бичигдсэн Фишерийн төсөөллийн томьёоны зүүн талд гидроксил бүлэгтэй гидрокси хүчлүүдийг тэмдгээр тэмдэглэнэ. Л; хэрэв гидроксил баруун талд проекцын томъёонд байрласан бол тэмдэг Д

Элсэн чихрийн тохиргоог тодорхойлох түлхүүр нь глицеральдегид юм.
L-(-)-глицеральдегид D-(+)-глицеральдегид
Элсэн чихрийн молекул дахь тэмдэглэгээ D-эсвэл L-тохиргоонд хамаарна доогууртэгш бус төв.
Систем D-,L-тэмдэглэгээ нь мэдэгдэхүйц сул талуудтай: нэгдүгээрт, тэмдэглэгээ D-эсвэл L-Энэ нь зөвхөн нэг тэгш бус атомын тохиргоог илэрхийлдэг; хоёрдугаарт, зарим нэгдлүүдийн хувьд глицеральдегид эсвэл гидрокси хүчлийн түлхүүрийг түлхүүр болгон авсан эсэхээс хамааран өөр өөр тэмдэглэгээг авдаг, жишээлбэл:

Түлхүүр системийн эдгээр дутагдал нь одоогоор түүний хэрэглээг элсэн чихэр, амин хүчил, гидрокси хүчил гэсэн гурван төрлийн оптик идэвхтэй бодисоор хязгаарлаж байна. Ерөнхий хэрэглээнд зориулагдсан R, S-систем Кан, Инголд, Прелог нар.
Оптик антиподын R- эсвэл S-тохиргоог тодорхойлохын тулд тэгш бус нүүрстөрөгчийн атомын эргэн тойронд орлуулагчдын тетраэдрийг хамгийн бага орлуулагч (ихэвчлэн устөрөгч) нь "ажиглагчаас хол" байхаар байрлуулах шаардлагатай. Дараа нь үлдсэн гурван орлуулагчийн тойрог дахь шилжилтийн үед ахмад настнаас дундаж нас, дараа нь хамгийн залуу руу шилжих хөдөлгөөн явагдана. цагийн зүүний эсрэг - ЭнэС -изомер (S үсгийг бичихэд ижил гар хөдөлгөөнтэй холбоотой), хэрэв цагийн зүүний дагуу - Энэ R- изомер (R үсэг бичих үед гарны хөдөлгөөнтэй холбоотой).
Тэгш бус атом дээрх орлуулагчдын насыг тодорхойлохын тулд атомын дугаарыг тооцоолох дүрмийг ашигладаг бөгөөд үүнийг геометрийн изомеруудын Z, E нэршилтэй холбогдуулан аль хэдийн хэлэлцсэн болно.

Проекцийн томъёоны дагуу R, S тэмдэглэгээг сонгохын тулд тэгш тоогоор (бидний мэдэж байгаагаар томъёоны стереохимийн утгыг өөрчилдөггүй) орлуулагчдыг хамгийн залуу нь байхаар байрлуулах шаардлагатай. тэдгээр нь (ихэвчлэн устөрөгч) проекцын томъёоны доод хэсэгт байдаг. Дараа нь цагийн зүүний дагуу унасан үлдсэн гурван орлуулагчийн нас нь R тэмдэглэгээтэй, цагийн зүүний эсрэг - S тэмдэглэгээтэй тохирч байна.
5. Стереоизомер авах арга
Дүрмээр бол стереоизомерийн хэлбэрүүдийн зөвхөн нэг нь биологийн идэвхтэй байдаг тул цэвэр стереоизомер авах нь чухал ажил юм. Үүний зэрэгцээ, ердийн нөхцөлд, дүрмээр бол стереоизомеруудын холимог үүсдэг - диастереомер эсвэл оптик антиподууд. Цэвэр стереоизомер хэлбэрийг олж авахын тулд эдгээр хольцууд.
3.Фишерийн проекцын томьёо
i-хавтгай дээр тэгш бус нүүрстөрөгчийн атом бүхий молекулуудыг дүрслэхийн тулд 18E1-д Э.Фишерийн санал болгосон проекцуудыг ихэвчлэн ашигладаг.
Бромофторохлорметан молекулын жишээн дээр тэдгээрийн барилгын зарчмыг авч үзье. Фишеоа проекцийг бүтээх эхлэлийн цэг нь молекулын орон зайн загвар эсвэл түүний шаантаг хэлбэртэй проекц юм.
Зурагт үзүүлсэн шиг зургийн хавтгайд зөвхөн бромфторохлорметан молекулын нүүрстөрөгчийн атом үлдэхээр молекулыг байрлуулъя.
Зургийн хавтгайд бүх атомуудыг проекц хийцгээе (Br ба CL нь зургийн хавтгайн доор байрладаг тул доороос дээш, F ба H нь дээрээс доош). Үүссэн төсөөлөл нь бүтцийн томъёоноос ялгаатай байхын тулд тэгш бус нүүрстөрөгчийн атомыг дүрслэхгүй байхыг бид зөвшөөрч байна. Тэр гэсэн утгатайБосоо болон хэвтээ шугамын огтлолцол дахь Фишерийн төсөөлөлд:

Дээрх жишээнээс харахад Фишерийн проекцийг орлуулагчтай тэгш бус атомын холбоог босоо болон хэвтээ (гэхдээ налуу биш!) шугамаар дүрсэлсэн байхаар бүтээжээ.
Фишерийн төсөөллийг ашиглахдаа тэдгээрийн босоо шугам нь биднээс холдож буй холболтыг, хэвтээ шугам нь бидэн рүү чиглэсэн холболтыг дүрсэлдэг гэдгийг санах нь зүйтэй. . Энэ нь Фишерийн төсөөллийг ашиглах дараах дүрмүүдэд хүргэдэг.
Фишерийн төсөөлөлтэй жагсаасан үйлдлүүдийг хийх боломжгүй, учир нь тэдгээр нь антиподын төсөөлөлд хүргэдэг.
Жишээ.
a) Хос сэлгэцийн тэгш тоо. Бромофторохлорметан молекул дахь F ба CI, Br ба H атомуудын байрлалыг сольж үзье.

б) Гурван орлуулагчийн дугуйлан дахин зохион байгуулалт. Галоген атомуудын дугуй зохион байгуулалтыг хийцгээе. Бид устөрөгчийн атомыг хөндөөгүй:

Хэд хэдэн нүүрстөрөгчийн атом агуулсан молекулуудын Фишерийн проекцын томъёог бүтээхдээ молекулыг нүүрстөрөгчийн гинжийг босоо байдлаар байрлуулна. Дээд талд байрлуулсан хамгийн их исэлддэгнүүрстөрөгчийн атом (дүрмээр бол энэ атом нь карбонил CH = O эсвэл карбоксил COOH бүлгийн нэг хэсэг юм):

IV. R,S - Стереоизомеруудын нэршил.
Энантиомерууд өөр өөр үнэмлэхүй тохиргоотой байдаг тул энэ ялгааг тэдний нэрээр илэрхийлэх ёстой. Хамгийн түгээмэл арга стереосомеруудын нэршлийг Р.Кан, С.Инголд, В.Прелог нар санал болгосон (R.S.Cahn, C.Ingold, V.Prelog, Angew.Chem. (1966), B.78, S.413-447, V. Прелог, Г.Хелмехен, Ангев.Чем (1982), Б.94, С.614-631). Тэдний хандлага нь дарааллын дүрэм гэж нэрлэгддэг дүрэмд суурилдаг бөгөөд үүний дагуу тэгш бус атом дээрх орлуулагчид байдаг. өөр өөр ахмад настнууд томилогддог. Дараа нь ажиглагчтай харьцуулахад молекулын тодорхой чиглэлийн хувьд орлуулагчдын нас буурах чиглэлийг авч үзнэ. Давуулалт хэрхэн унахаас хамаарч (цагийн зүүний дагуу эсвэл цагийн зүүний эсрэг) хиралийн төвийн тохиргоог R эсвэл S гэж тодорхойлдог.
1.R,S-номенклатурын зарчмууд
Бромофторохлорметан энантиомер (12) ба (13) жишээн дээр үнэмлэхүй тохиргоог нэрлэх процедурын үндсэн үе шатуудыг авч үзье.
Эхний шаттэгш хэмт бус атом дээр орлуулагчдын тэргүүлэх дарааллыг тодорхойлох явдал юм.
Тухайн элементийн изотопын насжилт нь массын тоо нэмэгдэх тусам нэмэгддэг.
Үүний дагуу бид бромфторохлорометан молекул дахь орлуулагчдын тэргүүлэх дарааллыг дараахь байдлаар авна.
Br>CI>F>H
Хамгийн ахмад орлогчийг a үсгээр, дараагийнхыг b үсгээр тэмдэглэнэ гэх мэт. (өөрөөр хэлбэл шилжилтийн үед a b c d давуу эрх буурдаг):

Хоёр дахь үе шат. Бид молекулыг хамгийн бага орлуулагчийг ажиглагчаас зайлуулж (энэ тохиолдолд нүүрстөрөгчийн атомаар бүрхэгдэнэ) байрлуулж, хамгийн бага орлуулагчтай нүүрстөрөгчийн холбооны тэнхлэгийн дагуу молекулыг авч үзье.

Гурав дахь шат. Аль чиглэлийг тодорхойлох УНХАЛТманай алсын хараанд байгаа депутатуудын ахмад настнууд. Хэрэв ахмад настны бууралт цагийн зүүний дагуу бол бид үүнийг R үсгээр тэмдэглэнэ (Латин "шулуун" баруун талаас). Хэрэв ахмад нас нь цагийн зүүний эсрэг байвал тохиргоог S үсгээр тэмдэглэнэ (Латин "муу" - зүүнээс).

R-изомер дахь орлуулагчдын насжилт буурах нь R үсгийн дээд талд, S-изомерт - ижил чиглэлд явагддаг мнемоник дүрэм байдаг. S үсгийн дээд талд:
Одоо бид энантиомеруудын бүрэн нэрийг бичиж болно, энэ нь тэдний үнэмлэхүй тохиргоог тодорхой харуулж байна:
Стерзоизомерын тохиргоог R эсвэл S гэж тэмдэглэх нь тэгш бус атом дээрх бүх дөрвөн орлуулагчийн тэргүүлэх дарааллаас хамаарна гэдгийг онцлон тэмдэглэх нь зүйтэй. Тиймээс доор үзүүлсэн молекулуудад X бүлэгтэй харьцуулахад F, CI, Br атомуудын орон зайн байршил ижил байна.

Өгөгдсөн жишээн дээр бид хөрвүүлэх тухай ярих боломжгүй үнэмлэхүй тохиргоо, эхлэлийн нэгдэл ба урвалын бүтээгдэхүүн нь изомер биш тул (дээрх хуудас 20-ыг үзнэ үү). Үүний зэрэгцээ нэг энантиомерыг нөгөөд хувиргах нь үнэмлэхүй тохиргоог өөрчлөх явдал юм.

II.1. Конформаци (эргэлтийн изомеризм)
Хамгийн энгийн органик нүүрсустөрөгч болох метанаас хамгийн ойрын гомолог болох этан руу шилжих нь орон зайн бүтцийн асуудал үүсгэдэг бөгөөд үүнийг шийдвэрлэхийн тулд энэ хэсэгт авч үзсэн параметрүүдийг мэдэх нь хангалтгүй юм. Үнэн хэрэгтээ бондын өнцөг болон уртыг өөрчлөхгүйгээр этан молекулын олон геометрийн хэлбэрийг төсөөлж болно, тэдгээр нь нүүрстөрөгчийн тетраэдрүүдийг холбосон C-C бондын эргэн тойронд харилцан эргэдэгээрээ бие биенээсээ ялгаатай байдаг. Энэхүү эргэлтийн үр дүнд эргэлтэт изомерууд (конформерууд) . Янз бүрийн конформеруудын энерги нь ижил биш боловч янз бүрийн эргэлтэт изомеруудыг тусгаарлах энергийн саад нь ихэнх органик нэгдлүүдийн хувьд бага байдаг. Тиймээс, ердийн нөхцөлд, дүрмээр бол молекулуудыг нэг хатуу тодорхойлсон конформацид тогтоох боломжгүй байдаг: ихэвчлэн бие биедээ амархан хувирдаг хэд хэдэн эргэлтийн хэлбэрүүд тэнцвэрт байдалд зэрэгцэн оршдог.
Конформац, тэдгээрийн нэршлийг графикаар дүрслэх аргууд нь дараах байдалтай байна. Этан молекулаас эхэлье. Үүний тулд энергийн хувьд хамгийн их ялгаатай хоёр конформаци байгааг урьдчилан харж болно. Тэдгээрийг доор харуулав хэтийн төлөвийн төсөөлөл (1) (“хөрөөний ямаа”), хажуугийн төсөөлөл (2) ба Ньюманы томъёо (3).
Хэтийн төлөвийн төсөөлөлд (1a, 1b) C-C холболтыг алсад төсөөлөх ёстой; Зүүн талд байгаа нүүрстөрөгчийн атом нь ажиглагчтай ойрхон, баруун талд байгаа нүүрстөрөгчийн атом түүнээс хол байна.
Хажуугийн төсөөлөлд (2a, 2b) дөрвөн H-атом нь зургийн хавтгайд байрладаг; Нүүрстөрөгчийн атомууд нь үнэндээ энэ хавтгайгаас тодорхой хэмжээгээр гадагшилдаг боловч тэдгээрийг ихэвчлэн зургийн хавтгайд байрладаг гэж энгийнээр үздэг. Шаантагны өтгөрөлтөөр "болд" шаантаг хэлбэртэй холбоосууд нь нягтрал руу чиглэсэн атомын ажиглагч руу хавтгайгаас гарахыг илтгэнэ. Тасархай шаантаг хэлбэртэй холболтууд нь ажиглагчаас зайг тэмдэглэнэ.
Ньюманы төсөөлөлд (3a, 3b) молекулыг С-С бондын дагуу (1a, b томъёонд сумаар заасан чиглэлд) авч үздэг. Тойргийн төвөөс 120 ° өнцгөөр зөрөх гурван шугам нь ажиглагчтай хамгийн ойр байгаа нүүрстөрөгчийн атомын холбоог илтгэнэ; Тойргийн цаанаас гарч буй шугамууд нь алс холын нүүрстөрөгчийн атомын холбоо юм.
Зүүн талд харуулсан конформацийг дуудна бүрхэгдсэн : Энэ нэр нь CH 3 бүлгийн устөрөгчийн атомууд бие биенийхээ эсрэг байгааг сануулж байна. хиртэгдсэн конформаци нь дотоод энергийг ихэсгэсэн тул тааламжгүй байдаг. Баруун талд үзүүлсэн конформацийг дуудна саатуулсан , энэ байрлалд С-С бондын эргэн тойрон дахь чөлөөт эргэлтийг "дарангуйлсан" гэсэн үг, өөрөөр хэлбэл. молекул нь энэ хэлбэрт голчлон оршдог.
Тодорхой холбоог тойрон молекулыг бүрэн эргүүлэхэд шаардагдах хамгийн бага энерги гэж нэрлэдэг эргэлтийн саад энэ холболтын хувьд. Этан гэх мэт молекул дахь эргэлтийн саадыг молекулын потенциал энергийн өөрчлөлтийн функцээр илэрхийлж болно. dihedral (torsion) өнцөг системүүд. Хоёр өнцөгт өнцгийг (тау гэж тэмдэглэсэн) доорх зурагт дүрсэлсэн болно.

Этан дахь С-С бондын эргэн тойрон дахь эргэлтийн энергийн төлөвийг дараах зурагт үзүүлэв. "Буцах" нүүрстөрөгчийн атомын эргэлтийг харуулсан хоёр устөрөгчийн атомын хоорондох хоёр талт өнцгийн өөрчлөлтөөр дүрслэгдсэн болно. Энгийн болгохын тулд үлдсэн устөрөгчийн атомуудыг орхигдуулсан. Этаны хоёр хэлбэрийг тусгаарлах эргэлтийн саад нь ердөө 3 ккал/моль (12.6 кЖ/моль) юм. Потенциал энергийн муруйн минимум нь дарангуйлагдсан конформацид, максимум нь хаалттай конформацид тохирно. Өрөөний температурт зарим молекулын мөргөлдөөний энерги 20 ккал / моль (ойролцоогоор 80 кЖ / моль) хүрч чаддаг тул энэ 12.6 кЖ / моль саадыг амархан даван туулж, этан дахь эргэлтийг чөлөөтэй гэж үздэг.

Боломжит энергийн муруйн цэг бүр нь тодорхой конформацид тохирч байгааг бид онцлон тэмдэглэв. Минимумд тохирох цэгүүд нь конформацийн изомеруудтай тохирч, өөрөөр хэлбэл бүх боломжит конформацийн холимог дахь зонхилох бүрэлдэхүүн хэсгүүд .
Молекул илүү нарийн төвөгтэй болохын хэрээр эрчим хүчний хувьд мэдэгдэхүйц ялгаатай байж болох конформацийн тоо нэмэгддэг. Тийм ээ, төлөө n-бутаныг аль хэдийн CH 3 бүлгүүдийн харьцангуй зохион байгуулалтаар ялгаатай зургаан хэлбэрт дүрсэлж болно, өөрөөр хэлбэл. төвийн холболтын эргэн тойронд эргэлт C-C. Доор n-бутаны конформацийг Ньюманы төсөөлөл хэлбэрээр дүрсэлсэн болно. Зүүн талд (сүүдэрт) харуулсан хэлбэрүүд нь эрчим хүчний хувьд тааламжгүй, зөвхөн дарангуйлагдсан хэлбэрүүд нь бараг хэрэгждэг.

Бутаны янз бүрийн хиртсэн болон дарангуйлагдсан конформаци нь энергийн хувьд ижил биш юм. Төв С-С бондын эргэн тойронд эргэлдэх үед үүссэн бүх конформацийн харгалзах энергийг доор үзүүлэв.



Молекул илүү төвөгтэй болохын хэрээр боломжит конформацийн тоо нэмэгддэг.
Тиймээс конформаци гэдэг нь тодорхой тохиргоотой молекулын янз бүрийн орон зайн хэлбэрүүд юм. Конформерууд нь хөдөлгөөнт тэнцвэрт байдалд байгаа стереоизомер бүтэц бөгөөд энгийн бондын эргэн тойронд эргэлдэж харилцан хувирах чадвартай.
Заримдаа ийм өөрчлөлтийн саад бэрхшээл нь стереоизомер хэлбэрийг салгахад хангалттай өндөр болдог (жишээ нь: оптик идэвхтэй бифенил;). Ийм тохиолдолд тэд конформеруудын тухай ярихаа больсон, харин үнэндээ байгаа тухай ярьдаг стереоизомерууд .
II.2. Геометрийн изомеризм
Давхар бондын хатуу байдлын чухал үр дагавар (түүний эргэн тойронд эргэлт байхгүй) оршин тогтнох явдал юм. геометрийн изомерууд . Тэдгээрийн хамгийн түгээмэл нь cis-транс изомерууд ханаагүй атомууд дээр тэгш бус орлуулагч агуулсан этилен цувралын нэгдлүүд. Хамгийн энгийн жишээ бол бутен-2-ийн изомерууд юм.

Геометрийн изомерууд нь ижил химийн бүтэцтэй (химийн бондын ижил дараалал), атомуудын орон зайн зохион байгуулалтаар ялгаатай байдаг. тохиргоо . Энэ ялгаа нь физик (түүнчлэн химийн) шинж чанарын ялгааг бий болгодог. Геометрийн изомерууд нь конформеруудаас ялгаатай нь цэвэр хэлбэрээр тусгаарлагдаж, бие даасан, тогтвортой бодис хэлбэрээр оршдог. Тэдний харилцан хувиргалтанд ихэвчлэн 125-170 кЖ/моль (30-40 ккал/моль) эрчим хүч шаардагддаг. Энэ энергийг халаах эсвэл цацраг туяагаар өгч болно.
Хамгийн энгийн тохиолдолд геометрийн изомеруудын нэршил нь ямар ч хүндрэл учруулдаггүй. cis- хэлбэрүүд нь геометрийн изомерууд бөгөөд тэдгээрт ижил орлуулагчид пи бондын хавтгайн нэг талд оршдог. транс- изомерууд пи бондын хавтгайн өөр өөр тал дээр ижил орлуулагчтай байдаг. Илүү төвөгтэй тохиолдолд үүнийг ашигладаг Z,E-номенклатур . Үүний гол зарчим: тохиргоог зааж өгөх cis-(З, Германы Зусамменаас - хамтдаа) эсвэл транс-(E, Германы Энтгегенээс - эсрэг талд) байршил ахлах орлогч нар давхар бондтой.
Z,E системд илүү өндөр атомын дугаартай орлуулагчдыг ахмад гэж үздэг. Хэрэв ханаагүй нүүрстөрөгчтэй шууд холбоотой атомууд ижил байвал тэд "хоёр дахь давхарга", шаардлагатай бол "гурав дахь давхарга" руу шилждэг.
Z,E-номенклатурын дүрмийн хэрэглээг хоёр жишээгээр авч үзье.

| I | II |
Бүх зүйлийг "эхний давхарга" -ын атомууд шийддэг I томъёоноос эхэлье. Тэдний атомын дугаарыг байрлуулсны дараа хос тус бүрийн ахлах орлуулагчид (томъёоны дээд хэсэгт бром, доод хэсэгт азот) байгааг олж мэдэв. транс-байрлал, иймээс стереохимийн тэмдэглэгээ E:
 E-1-бромо-1-хлоро-2-нитроэтин
E-1-бромо-1-хлоро-2-нитроэтин
II бүтцийн стереохимийн тэмдэглэгээг тодорхойлохын тулд "дээд давхаргууд" дахь ялгааг хайх шаардлагатай. Эхний давхаргад CH 3, C 2 H 5, C 3 H 7 бүлгүүд ялгаатай биш юм. Хоёрдахь давхаргад CH 3 бүлэг нь гурван (гурван устөрөгчийн атом) атомын тооны нийлбэртэй, C 2 H 5 ба C 3 H 7 бүлэгт тус бүр 8 байна. Энэ нь CH 3 бүлгийг тооцохгүй гэсэн үг юм. нөгөө хоёроосоо залуу байна. Тиймээс ахлах бүлгүүд нь C 2 H 5 ба C 3 H 7, энэ нь байна cis-байрлал; стереохимийн тэмдэглэгээ Z.
 Z-3-метилгептен-3
Z-3-метилгептен-3
Хэрэв C 2 H 5 эсвэл C 3 H 7 гэсэн аль бүлэг илүү хуучин болохыг тодорхойлох шаардлагатай бол "гурав дахь давхарга" -ын атомууд руу шилжих шаардлагатай болно; энэ давхаргын атомын тооны нийлбэр нь хоёр бүлгийн хувьд тэнцүү байх болно. 3 ба 8 хүртэл, i.e. C3H7 нь C2H5-аас хуучин. Давуу байдлыг тодорхойлох илүү төвөгтэй тохиолдлуудад нэмэлт нөхцөлийг харгалзан үзэх шаардлагатай, тухайлбал: давхар бондоор холбогдсон атомыг хоёр удаа, гурвалсан холбоогоор холбосон атомыг гурван удаа тоолох; Изотопуудаас илүү хүнд нь хуучин (дейтерий нь устөрөгчөөс илүү эртний) болон бусад зарим нь юм.
Тэмдэглэгээ Z гэдгийг анхаарна уу Үгүй синонимууд юм cis- E тэмдэглэгээ шиг тэмдэглэгээ нь байршилтай үргэлж таарч байдаггүй транс-, Жишээлбэл:

cis- 1,2-дихлорпропен-1 cis- 1,2-дихлоро-1-бромопропен-1
Z-1,2-дихлоропропен-1 E-1,2-дихлоро-1-бромопропен-1
Хяналтын даалгавар
1. Бомбикол - торгон хорхойн феромон (бэлгийн татагч) нь E-10-Z-12-hexadecadienol-1 юм. Түүний бүтцийн томьёог зур.
2. Дараах нэгдлүүдийг Z,E нэршил ашиглан нэрлэнэ үү.

II.3. Оптик изомеризм (энантиомеризм)
Органик нэгдлүүдийн дунд гэрлийн туйлшралын хавтгайг эргүүлэх чадвартай бодисууд байдаг. Энэ үзэгдлийг оптик идэвхжил гэж нэрлэдэг бөгөөд холбогдох бодисууд нь байдаг оптик идэвхтэй . Оптик идэвхтэй бодисууд нь хосоороо тохиолддог оптик антиподууд - нэг зүйлийг эс тооцвол ердийн нөхцөлд физик, химийн шинж чанар нь ижил изомерууд - туйлшралын хавтгайн эргэлтийн тэмдэг. (Хэрэв оптик антиподуудын аль нэг нь жишээлбэл, тодорхой эргэлттэй байна [ТАЙЛБАР 1] +20 o, нөгөө нь -20 o эргэлттэй байна).
II.4. Проекцийн томъёо
Хавтгай дээрх тэгш бус атомыг ердийн байдлаар дүрслэхийн тулд ашиглана уу Э.Фишерийн төсөөллийн томьёо . Тэдгээрийг тэгш хэмт бус атомтай холбоотой атомуудыг хавтгайд тусгах замаар олж авдаг. Энэ тохиолдолд тэгш хэмт бус атомыг ихэвчлэн орхигдуулдаг бөгөөд зөвхөн огтлолцсон шугамууд болон орлуулагч тэмдгүүдийг хадгалдаг. Орлуулагчдын орон зайн зохион байгуулалтыг санахын тулд проекцын томъёонд эвдэрсэн босоо шугамыг ихэвчлэн хадгалдаг (дээд ба доод орлуулагчдыг зургийн хавтгайгаас гадуур арилгадаг), гэхдээ энэ нь ихэвчлэн хийгддэггүй. Өмнөх зураг дээрх зүүн загварт тохирох проекцын томъёог бичих өөр өөр аргуудыг доор харуулав.

Проекцийн томъёоны зарим жишээ энд байна:

(+)-аланин (-)-бутанол (+)-глицеральдегид
Бодисын нэрс нь тэдний эргэлтийн шинж тэмдгийг илтгэнэ: энэ нь жишээлбэл, бутанол-2-ийн зүүн гартай антиподтой гэсэн үг юм. орон зайн тохиргоо , дээрх томьёогоор нарийн илэрхийлсэн бөгөөд түүний толин тусгал дүрс нь декстроротатор бутанол-2-той тохирч байна. Тохиргооны тодорхойлолт оптик антиподуудыг туршилтаар хийдэг [ТАЙЛБАР 3].
Зарчмын хувьд оптик антипод бүрийг арван хоёр (!) өөр проекцийн томъёогоор дүрсэлж болно - проекцын явцад загвар хэрхэн байрлаж байгаа, аль талаас нь харж байгаагаас хамаарна. Төсөөллийн томъёог стандартчилахын тулд тэдгээрийг бичих тодорхой дүрмийг нэвтрүүлсэн. Тиймээс, үндсэн функц нь гинжний төгсгөлд байвал ихэвчлэн дээд хэсэгт байрладаг бол гол гинжийг босоо байдлаар дүрсэлсэн байдаг.
"Стандарт бус" бичмэл төсөөллийн томьёог харьцуулахын тулд та проекцын томъёог хувиргах дараах дүрмийг мэдэх хэрэгтэй.
1. Томъёог стереохимийн утгыг өөрчлөхгүйгээр зургийн хавтгайд 180° эргүүлэх боломжтой.

2. Нэг тэгш бус атом дээрх орлуулагчдын хоёр (эсвэл тэгш тоо) дахин зохион байгуулалт нь томъёоны стереохимийн утгыг өөрчлөхгүй.

3. Тэгш бус төв дэх орлуулагчдын нэг (эсвэл ямар нэгэн сондгой тоо) солигдох нь оптик антиподын томъёонд хүргэдэг.

4. Зургийн хавтгайд 90 ° эргүүлэх нь томьёог эсрэг байрлал болгон хувиргадаг, хэрэв тэр үед зургийн хавтгайтай харьцуулахад орлуулагчдын байршлын нөхцөл өөрчлөгдөөгүй бол өөрөөр хэлбэл. Одоо хажуугийн орлуулагчид нь зургийн хавтгайн ард, дээд ба доод хэсгүүд нь урд талд байрладаг гэж бүү бодоорой. Хэрэв та тасархай шугамтай томъёо ашигладаг бол тасархай шугамын өөрчилсөн чиглэл нь танд үүнийг шууд сануулах болно.

5. Сэлгээний оронд проекцийн томьёог дурын гурван орлуулагчийг цагийн зүүний дагуу эсвэл цагийн зүүний эсрэг эргүүлэх замаар өөрчилж болно; дөрөв дэх орлуулагч нь байрлалаа өөрчлөхгүй (энэ үйлдэл нь хоёр дахин зохион байгуулалттай тэнцэнэ):

6. Төслийн томьёог зургийн хавтгайгаас гаргаж авах боломжгүй (жишээ нь, та тэдгээрийг цаасны ар талаас "гэрэлд" шалгах боломжгүй - энэ тохиолдолд томьёоны стереохимийн утга өөрчлөгдөх болно).
II.5. Уралдааны нөхөд
Хэрэв бодисын томьёо нь тэгш бус атом агуулдаг бол энэ нь ийм бодис оптик идэвхжилтэй болно гэсэн үг биш юм. Хэрэв хэвийн урвалын үед тэгш хэмт бус төв үүсвэл (CH 2 бүлэгт орлуулах, давхар бондын нэмэлт гэх мэт) антиподеаны тохиргоог хоёуланг нь үүсгэх магадлал ижил байна. Тиймээс, бие даасан молекул бүрийн тэгш бус байдлыг үл харгалзан үүссэн бодис нь оптик идэвхгүй болж хувирдаг. Энэ төрлийн оптик идэвхгүй өөрчлөлтийг хоёуланг нь ижил хэмжээтэй антипод гэж нэрлэдэг уралдааны нөхөд [ТАЙЛБАР 4] .
II.6. Диастереомеризм
Хэд хэдэн тэгш бус атом бүхий нэгдлүүд нь нэг тэгш бус төвтэй, өмнө нь авч үзсэн энгийн оптик идэвхтэй бодисуудаас ялгах чухал шинж чанартай байдаг.
Тодорхой бодисын молекулд хоёр тэгш бус атом байдаг гэж үзье; Тэдгээрийг болзолт A ба B гэж нэрлэе. Дараах хослол бүхий молекулууд боломжтой болохыг харахад хялбар байдаг.
1 ба 2-р молекулууд нь хос оптик антипод юм; 3 ба 4-р хос молекулуудад мөн адил хамаарна. Хэрэв бид өөр өөр хос антиподын молекулуудыг - 1 ба 3, 1 ба 4, 2 ба 3, 2 ба 4 -ийг өөр хоорондоо харьцуулж үзвэл жагсаасан хосууд харагдах болно. оптик антипод биш: нэг тэгш бус атомын тохиргоо ижил, нөгөөгийнх нь тохиргоо ижил биш байна. Эдгээр нь бүгд хосууд юм диастереомерууд , өөрөөр хэлбэл орон зайн изомерууд, Үгүй бие биетэйгээ оптик антиподуудыг бүрдүүлдэг.
Диастереомерууд нь бие биенээсээ зөвхөн оптик эргэлтээр төдийгүй бусад бүх физик тогтмолуудаараа ялгаатай байдаг: өөр өөр хайлах болон буцалгах цэгүүд, өөр өөр уусах чадвар гэх мэт Диастереомеруудын шинж чанаруудын ялгаа нь бүтцийн изомеруудын шинж чанарын ялгаанаас багагүй байдаг. .
Энэ төрлийн нэгдлүүдийн жишээ бол хлоромалийн хүчил юм

Түүний стереоизомер хэлбэрүүд нь дараах төсөөллийн томьёотой байна.

эритро-хэлбэрүүд гурван-хэлбэрүүд
Гарчиг эритро- Тэгээд гурвалсан- эритроз ба триоз гэсэн нүүрс усны нэрнээс гаралтай. Эдгээр нэрсийг хоёр тэгш бус атомтай нэгдлүүдийн орлуулагчдын харьцангуй байрлалыг зааж өгөхөд ашигладаг. эритро - изомеруудЭдгээр нь нэг талдаа (баруун эсвэл зүүн) стандарт проекцын томъёонд хоёр ижил хажуугийн орлуулагч гарч ирдэг хүмүүс юм; гурвалсан - изомеруудпроекцын томъёоны өөр өөр талд ижил хажуугийн орлуулагчтай байна [ТАЙЛБАР 5].
Хоёр эритро-изомерууд нь хос оптик антиподууд бөгөөд тэдгээрийг холиход рацемат үүсдэг. Хос оптик изомерууд нь ба гурван-хэлбэрүүд; мөн тэдгээр нь холилдсон үед ракемат үүсгэдэг бөгөөд энэ нь ракематаас шинж чанараараа ялгаатай эритро-хэлбэрүүд. Тиймээс хлоромалийн хүчлийн нийт дөрвөн оптик идэвхтэй изомер ба хоёр рацемат байдаг.
Тэгш бус төвүүдийн тоо цаашид нэмэгдэхийн хэрээр орон зайн изомеруудын тоо нэмэгдэж, шинэ тэгш бус төв бүр изомеруудын тоог хоёр дахин нэмэгдүүлнэ. Энэ нь 2 n томьёогоор тодорхойлогддог бөгөөд энд n нь тэгш бус төвүүдийн тоо юм.
Зарим бүтэц дэх хэсэгчилсэн тэгш хэмийн улмаас стереоизомеруудын тоо буурч болно. Үүний нэг жишээ бол дарсны хүчил бөгөөд бие даасан стереоизомеруудын тоо гурав хүртэл буурдаг. Тэдний төсөөллийн томъёо:

Формула I нь Ia томьёотой адилхан: зургийн хавтгайд 180° эргүүлэх үед энэ нь өөрчлөгддөг тул шинэ стереоизомер биш юм. Энэ бол оптик идэвхгүй өөрчлөлт юм - мезо хэлбэр . Ракематаас ялгаатай нь оптик болгон хувааж болно антиподууд, мезо-хэлбэр нь үндсэндээ устаж үгүй болно: түүний молекул бүр нь нэг тохиргооны нэг тэгш бус төвтэй, хоёр дахь нь эсрэгээрээ байдаг. Үүний үр дүнд хоёр тэгш бус төвийн эргэлтийн молекулын нөхөн олговор үүсдэг.
Мезо-Бүх оптик идэвхтэй бодисууд нь хэд хэдэн ижил (жишээ нь, ижил орлуулагчтай холбоотой) тэгш бус төвүүдтэй хэлбэртэй байдаг [ТАЙЛБАР 6]. Проекцийн томъёо мезо-Хэвтээ шугамаар тэдгээрийг хоёр хагас болгон хувааж болох бөгөөд цаасан дээр бичсэнээр албан ёсоор ижил боловч бодит байдал дээр толин тусгалтай байдаг тул хэлбэрийг үргэлж хүлээн зөвшөөрч болно.

II ба III томъёо нь дарсны хүчлийн оптик антиподуудыг дүрсэлсэн; тэдгээрийг холих үед оптик идэвхгүй ракемат үүсдэг - усан үзмийн хүчил.
II.7. Оптик изомеруудын нэршил
Хамгийн энгийн, хамгийн эртний, гэхдээ одоо ч ашиглагдаж байгаа оптик антиподын нэр томъёо нь "түлхүүр" болгон сонгосон тодорхой стандарт бодисын проекцын томьёотой гэж нэрлэгддэг антиподын проекцын томъёог харьцуулах үндсэн дээр суурилдаг. Тиймээс альфа гидрокси хүчил ба альфа амин хүчлүүдийн хувьд гол нь тэдгээрийн проекцын томьёоны дээд хэсэг (стандарт тэмдэглэгээнд):

L-гидрокси хүчил (X = OH) D-гидрокси хүчил (X = OH)
L-амин хүчлүүд (X = NH 2) D-амин хүчил (X = NH 2)
Стандарт бичигдсэн Фишерийн төсөөллийн томьёоны зүүн талд гидроксил бүлэгтэй бүх альфа-гидрокси хүчлүүдийн тохиргоог тэмдгээр тэмдэглэв. Л; хэрэв гидроксил баруун талд проекцын томъёонд байрласан бол тэмдэг Д[ТАЙЛБАР 7] .
Элсэн чихрийн тохиргоог тодорхойлох түлхүүр нь глицеральдегид юм.

L-(-)-глицеральдегид D-(+)-глицеральдегид
Элсэн чихрийн молекул дахь тэмдэглэгээ D-эсвэл L-тохиргоонд хамаарна доогууртэгш бус төв.
Систем D-,L-тэмдэглэгээ нь мэдэгдэхүйц сул талуудтай: нэгдүгээрт, тэмдэглэгээ D-эсвэл L-Энэ нь зөвхөн нэг тэгш бус атомын тохиргоог илэрхийлдэг; хоёрдугаарт, зарим нэгдлүүдийн хувьд глицеральдегид эсвэл гидрокси хүчлийн түлхүүрийг түлхүүр болгон авсан эсэхээс хамааран өөр өөр тэмдэглэгээг авдаг, жишээлбэл:

Түлхүүр системийн эдгээр дутагдал нь одоогоор түүний хэрэглээг элсэн чихэр, амин хүчил, гидрокси хүчил гэсэн гурван төрлийн оптик идэвхтэй бодисоор хязгаарлаж байна. Ерөнхий хэрэглээнд зориулагдсан "R, S-систем Кан, Инголд, Прелог [ТАЙЛБАР 8].
Оптик антиподын R- эсвэл S-тохиргоог тодорхойлохын тулд тэгш бус нүүрстөрөгчийн атомын эргэн тойронд орлуулагчдын тетраэдрийг хамгийн бага орлуулагч (ихэвчлэн устөрөгч) нь "ажиглагчаас хол" байхаар байрлуулах шаардлагатай. Дараа нь үлдсэн гурван орлуулагчийн тойрог дахь шилжилтийн үед ахмад настнаас дундаж нас, дараа нь хамгийн залуу руу шилжих хөдөлгөөн явагдана. цагийн зүүний эсрэг - Энэ Р -изомер (R үсэг бичихэд ижил гар хөдөлгөөнтэй холбоотой), хэрэв цагийн зүүний дагуу - Энэ S- изомер (S үсгийг бичихэд ижил гар хөдөлгөөнтэй холбоотой).
Тэгш бус атом дээрх орлуулагчдын насыг тодорхойлохын тулд атомын дугаарыг тооцоолох дүрмийг ашигладаг бөгөөд үүнийг геометрийн изомеруудын Z, E нэршилтэй холбогдуулан аль хэдийн авч үзсэн болно (үзнэ үү).
Проекцийн томъёоны дагуу R, S тэмдэглэгээг сонгохын тулд тэгш тоогоор (бидний мэдэж байгаагаар томъёоны стереохимийн утгыг өөрчилдөггүй) орлуулагчдыг хамгийн залуу нь байхаар байрлуулах шаардлагатай. тэдгээр нь (ихэвчлэн устөрөгч) проекцын томъёоны доод хэсэгт байдаг. Дараа нь цагийн зүүний дагуу унасан үлдсэн гурван орлуулагчийн нас нь R тэмдэглэгээтэй, цагийн зүүний эсрэг - S тэмдэглэгээтэй тохирч байна [ТАЙЛБАР 9]:

Хяналтын даалгавар
3. Аскорбины хүчлийн (витамин С) тэгш бус төвийн тохиргоог тодорхойлно. Р, С-номенклатур ба глицеральдегидтэй харьцуулахад):

4. Эфедрин алкалоид нь дараах томьёотой.

Энэ холболтыг ашиглан нэр өгнө үү Р, С- нэршил.
5. Цистеин нь бодисын солилцооны үйл явцыг зохицуулахад оролцдог чухал бус амин хүчил юм. Л-1-амин-2-меркаптопропионы хүчил. Түүний бүтцийн томьёог зурж, нэрийг нь өг Р, С- нэршил.
6. Левомицетин (өргөн хүрээний антибиотик) нь Д(-)-трио-1-п-нитрофенил-2-дихлорацетиламино-пропандиол-1,3. Түүний бүтцийг Фишерийн проекцын томъёо хэлбэрээр зур.
7. Synestrol нь стероид бус бүтэцтэй эстроген дааврын нийлэг эм юм. Стереохимийн тохиргоог харуулсан нэр өгнө үү:

II.8. Цикл нэгдлүүдийн стереохими
Нүүрстөрөгчийн атомын гинжийг хавтгай мөчлөгт хаах үед нүүрстөрөгчийн атомуудын холбоосын өнцөг нь ердийн тетраэдр утгаасаа хазайхад хүргэдэг бөгөөд энэ хазайлтын хэмжээ нь цикл дэх атомуудын тооноос хамаарна. Валентын бондын хазайлтын өнцөг их байх тусам молекулын энергийн нөөц их байх тусам эргэлт бага тогтвортой байна. Гэсэн хэдий ч зөвхөн гурван гишүүнтэй циклик нүүрсустөрөгч (циклопропан) нь хавтгай бүтэцтэй; Циклобутанаас эхлээд циклоалкан молекулууд нь хавтгай бус бүтэцтэй байдаг бөгөөд энэ нь систем дэх "хүчдэл" -ийг бууруулдаг.
Циклогексаны молекул нь "хэвийн" холбоосын өнцгийг хадгалсан хэд хэдэн хэлбэрт байж болно (энгийн байхын тулд зөвхөн нүүрстөрөгчийн атомуудыг харуулсан болно):

Хамгийн эрч хүчтэй конформаци бол хэлбэр гэж нэрлэгддэг I хэлбэр юм "сандал". Зохицуулалт II - "мушгих" - завсрын байрлалыг эзэлдэг: энэ нь сандлын конформацаас бага таатай (түүн доторх устөрөгчийн атомууд байдаг тул), гэхдээ III конформацаас илүү таатай байдаг. Зохицуулалт III - "усанд орох" - дээшээ чиглэсэн устөрөгчийн атомууд мэдэгдэхүйц түлхэлттэй тул гурваас хамгийн бага таатай.
Арван хоёр C-H бондыг сандлын конформацид авч үзэх нь тэдгээрийг хоёр бүлэгт хуваах боломжийг олгодог: зургаан тэнхлэгийн дээш доош ээлжлэн чиглэсэн холболтууд ба зургаа экваторын талууд руу чиглэсэн холболтууд. Монор орлуулсан циклогександ орлуулагч нь экваторын болон тэнхлэгийн байрлалд байж болно. Эдгээр хоёр конформаци нь ихэвчлэн тэнцвэрт байдалд байдаг бөгөөд мушгирсан конформацаар бие биедээ хурдан шилждэг.

Экваторын конформаци (e) нь ихэвчлэн энергийн хувьд муу байдаг тул тэнхлэгийн (a) хэлбэрээс илүү давуу талтай байдаг.
Орлуулагчид (хажуугийн гинж) цагирагт гарч ирэхэд цагирагийн зохицлын асуудлаас гадна судлаачид бас асуудал тулгардаг. орлуулагчийн тохиргоо : иймээс хоёр ижил буюу өөр орлуулагч байгаа тохиолдолд, cis-trans-изомер. тухай ярьж байгааг анхаарна уу cis-trans-Орлуулагчдын тохиргоо нь ханасан жижиг, дунд цагиргуудад (C 8 хүртэл) хэрэглэхэд л утга учиртай байдаг: олон тооны нэгж бүхий цагиргуудад хөдөлгөөнт байдал нь маш их ач холбогдолтой болдог тул энэ талаар хэлэлцүүлэг өрнөж байна. cis-эсвэл транс- депутатуудын байр суурь утгаа алддаг.
Тиймээс сонгодог жишээ бол стереоизомер циклопропан-1,2-дикарбоксилын хүчил юм. Хоёр стереоизомерийн хүчил байдаг: тэдгээрийн нэг нь m.p. 139 o C нь циклик ангидрид үүсгэх чадвартай тул cis-изомер. Өөр нэг стереоизомерийн хүчил м.п. 175 o C, циклийн ангидрид үүсгэдэггүй; Энэ транс-изомер [ТАЙЛБАР 10]:

Хоёр стереоизомер 1,2,2-триметилциклопентан-1,3-дикарбоксилын хүчил нь хоорондоо ижил харилцаатай байдаг. Тэдний нэг нь гавар хүчил, м.п. 187 o C, ангидрид үүсгэдэг тул ийм байна cis-изомер. Нөгөө нь изокамфорын хүчил, м.п. 171 o C, - ангидрид үүсгэдэггүй, энэ транс-изомер:
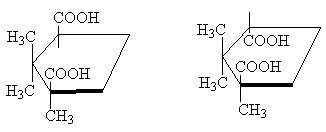
cis-trans-
Циклопентан молекул нь үнэндээ хавтгай биш боловч тодорхой болгохын тулд дээрх зураг дээрх шиг хавтгай хэлбэрээр дүрслэх нь тохиромжтой. cis-изомер нь хоёр орлуулагчтай мөчлөгийн нэг талд , болон дотор транс-изомер - мөчлөгийн эсрэг талд .
Хоёр орлуулсан циклогексаны деривативууд нь cis эсвэл транс хэлбэрээр байж болно.
Нүүрстөрөгчийн атом нь органик нэгдлүүдийн молекулуудад хирал төвүүдийг бий болгох монополь эрх мэдэлтэй байдаггүй. Дөрөвдөгч аммонийн давс, гуравдагч амин исэлд агуулагдах цахиур, цагаан тугалга, тетраковалент азотын атомууд мөн хиралийн төв байж болно.

Эдгээр нэгдлүүдийн хувьд тэгш бус байдлын төв нь тэгш бус нүүрстөрөгчийн атом шиг тетраэдр бүтэцтэй байдаг. Гэсэн хэдий ч хирал төвийн өөр өөр орон зайн бүтэцтэй нэгдлүүд бас байдаг.
Гурвалсан азот, фосфор, хүнцэл, сурьма, хүхрийн атомуудаас бүрдсэн хирал төвүүд нь пирамид хэлбэртэй байдаг. Зарчмын хувьд гетероатомын дан электрон хосыг дөрөв дэх орлуулагчаар авбал тэгш бус байдлын төвийг тетраэдр гэж үзэж болно.

Оптик идэвхжил ч тохиолдож болно гүйгээр бүхэл бүтэн молекулын бүтцийн хираль байдлаас шалтгаалан хирал төв ( молекулын хирализм эсвэл молекулын тэгш бус байдал ). Хамгийн ердийн жишээ бол оршихуй юм хираль тэнхлэг эсвэл хираль хавтгай .
Хирал тэнхлэг нь жишээлбэл, янз бүрийн орлуулагч агуулсан алленуудад илэрдэг sp 2- эрлийз нүүрстөрөгчийн атомууд. Доорх нэгдлүүд нь толин тусгал дүрс, тиймээс оптик антиподууд болохыг харахад хялбар байдаг.

Хиралийн тэнхлэгийг сумаар зурагт үзүүлэв.
Хирал тэнхлэгтэй өөр нэг ангиллын нэгдлүүд нь оптик идэвхтэй бифенилүүд юм орто-байрлалууд нь арены цагиргийг холбосон С-С бондын эргэн тойронд чөлөөт эргэлтэнд саад болох их хэмжээний орлуулагчтай байдаг:

Хирал онгоц Энэ нь "дээд" ба "доод", мөн "баруун" ба "зүүн" талуудын хооронд ялгагдах боломжтой гэдгээрээ онцлог юм. Хирал хавтгайтай нэгдлүүдийн жишээ бол оптик идэвхтэй бодис юм транс-циклоотен ба оптик идэвхтэй ферроцений дериватив.
Эдгээр томъёог ихэвчлэн агуулсан молекулуудын орон зайн дүрслэлд ашигладаг тэгш бус нүүрстөрөгчийн атом : энэ нь тетраэдр ( sp 3-эрлийз) дөрвөн өөр атом эсвэл атомын бүлэгт холбогдсон нүүрстөрөгчийн атом.
Проекцийн томъёог дүрслэхийн тулд молекулын тетраэдр загварыг тэгш хэмт бус атом нь зургийн хавтгайд байхаар байрлуулсан бөгөөд тэгш бус нүүрстөрөгчийн атомын хоёр холбоо нь зургийн хавтгайгаас ажиглагч руу цухуйсан хэвтээ хавтгайд байрладаг. . Үлдсэн хоёр холболт нь зургийн хавтгайгаас цааш ажиглагчаас хол, босоо хавтгайд байрлах ёстой.
Фишерийн төсөөллийг ашиглахдаа тэгш бус нүүрстөрөгчийн атомын тэмдэглэгээг ихэвчлэн орхигдуулдаг.
Фишерийн томъёонууд нь хавтгай дээрх проекц бөгөөд орон зайн загвар гэж үзэх ёсгүй гэдгийг үргэлж анхаарч үзэх хэрэгтэй.
Тиймээс дараахь дүрмийг дагаж мөрдөх шаардлагатай.
тодорхой стереоизомерт харгалзах проекцийн томъёог зургийн хавтгайгаас салгах боломжгүй бөгөөд хавтгайд 90 o ба 270 o-ээр эргүүлэх боломжгүй;
томъёог 180 ° эргүүлэх боломжтой

Хэрэв нэг атомын бүлгийн байрлал өөрчлөгдөхгүй бол бусад гурвыг цагийн зүүний дагуу эсвэл цагийн зүүний эсрэг эргүүлж болно.

4.2. Оптик идэвхжил* ба чираль байдал
Оптик идэвхжил гэдэг нь бодисын туйлширсан гэрлийн хавтгайг эргүүлэх (тодорхой өнцгөөр хазайх) шинж чанар, чадварыг хэлнэ.
Туйлшралын хавтгайн эргэлт нь цагийн зүүний дагуу (баруун эргэлт) эсвэл цагийн зүүний эсрэг (зүүн эргэлт) явагддаг.
Нэг тэгш бус нүүрстөрөгчийн атом агуулсан нэгдлүүдийн хувьд бие биетэйгээ бие биетэйгээ холбоотой, түүний толин тусгал дүрс бүхий хоёр изомер байж болно, үүнийг сүүн хүчлийн жишээнээс харж болно.


Тус бүр нь нөгөөгийнхөө толин тусгал дүрс болох хоёр изомерыг нэрлэдэг оптик эсвэл толин тусгал изомерууд .
Ийм хос толин тусгал изомер гэж нэрлэдэг энантиомерууд эсвэл оптик антиподууд .
Энантиомерууд нь туйлшралын хавтгайн эргэлтийн чиглэлээс бусад ижил физик шинж чанартай байдаг: тэдгээр нь туйлширсан гэрлийг ижил өнцгөөр, гэхдээ эсрэг чиглэлд хазайдаг.
Толин тусгал дүрстэйгээ үл нийцэх нэгдлүүдийг нэрлэдэг хирал .
Chirality (cheir - гараас) нь стереохимийн үндсэн ойлголт бөгөөд объектын толин тусгал дүрстэй үл нийцэх шинж чанарыг илэрхийлдэг; нь молекулуудын оптик үйл ажиллагааны урьдчилсан нөхцөл юм.
Энантиомерын аль алиных нь тэнцүү хэмжээгээр бүрдсэн бодисын хольцыг нэрлэдэг ракемик хольц . Ийм хольцын оптик идэвхжил 0 байна.
Энантиомер биш стереоизомеруудыг нэрлэдэг диастереомерууд (дэлгэрэнгүйг доороос 4.4-р хэсгээс үзнэ үү).
Тиймээс бүх хирал молекулууд нь оптик идэвхтэй нэгдлүүдийн молекулууд юм.
Хиралт ба оптик идэвхжил хоёрын хооронд нэгээс нэг захидал харилцаа байдаг. Хирал молекулуудын онцлог шинж чанар нь тэнхлэг, төв, тэгш хэмийн хавтгай байхгүй байх явдал юм. тэгш хэмийн элементүүд .
Тэгш хэмийн тэнхлэг.Молекулыг 2π/n=360 o/n өнцгөөр дайран өнгөрч буй тэнхлэгийг тойрон эргэх нь түүнийг дахин анхны байдалд нь оруулбал ийм тэнхлэгийг гэнэ. n-р эрэмбийн тэгш хэмийн тэнхлэг С n . n=1 гэсэн утгатай ямар ч тохиолдолд тэнхлэгийг тойрон эргэх нь молекулыг анхны байдалд нь буцаана гэдэг нь ойлгомжтой.
Жишээлбэл, усны молекул (a) нь хоёр дахь зэрэглэлийн тэгш хэмийн тэнхлэгтэй (n=2), хлорметан (b) гуравдугаар зэрэгтэй, бензолд (в) зургаан тэнхлэгийн хамт циклийн хавтгайд (n) байрладаг. =2), мөчлөгийн хавтгайд перпендикуляр өөр нэг тэнхлэг (n=6) байна.

Тэгш хэмийн хавтгай.Хэрэв молекулыг (объект) дайран өнгөрч буй хавтгай нь түүнийг толин тусгал изомер хэлбэрээр холбосон хоёр хэсэгт хуваавал үүнийг гэнэ. тэгш хэмийн хавтгай . Ус нь хоёр тэгш хэмийн хавтгайтай, хлорметан гурван хавтгайтай.

Тэгш хэмийн төв i- энэ нь молекулын төв дэх цэг бөгөөд өгөгдсөн молекулын хоёр эквивалент, эквивалент цэгүүд нэг шулуун дээр байрладаг ижил зайд байрладаг.
Молекул нь нэгээс олон тэгш хэмийн төвтэй байж болохгүй.
Тиймээс молекул дахь тэгш хэмийн элементүүд байгаа эсэхээс үзэхэд энэ талаар ярих нь заншилтай байдаг. хирализм Тэгээд ахирализм . Ихэнх тохиолдолд тэдгээрийн утга нь "тэгш хэм" ба "тэгш хэм" гэсэн ойлголттой давхцдаг. Гэсэн хэдий ч хирал молекул нь тэгш хэмийн зарим элементүүдийг агуулж болох тул чираль байдал нь тэгш бус байдлаас хамаагүй өргөн ойлголт юм. Үүнтэй ижил шалтгаанаар стереохимийн шинжлэх ухаанд "асимметрик" атом гэсэн нэр томъёог ихэвчлэн "хирал байдлын төв" гэсэн нэр томъёогоор сольдог. Тиймээс хиралитийг тухайн объектын толин тусгал дүрстэй үл нийцэх шинж чанар гэж ойлгох хэрэгтэй. Ахирал молекул нь дор хаяж нэг тэгш хэмийн элементийг (төв эсвэл тэгш хэмийн хавтгай) агуулдаг. Ахиралитийн онцгой тохиолдол бол хирализм: Нэг бүтцийн фрагментийн нэг удаагийн өөрчлөлтөөр ахирал молекулын хираль болж хувирах чадвар, шинж чанар. Дүрмээр бол, хэрэв байгаа бол ийм үйлдэл хийх боломжтой прохирал төв – өөрөөр хэлбэл, хоёр өөр, хоёр ижил орлуулагч агуулсан төв. Эдгээр ижил орлуулагчдын аль нэгийг одоо байгаа бүх орлуулагчаас өөр өөр орлуулагчаар солих нь энэ төвийг хирал болгон хувиргадаг.

Тохиргоо ба тохируулга
Стереоизомер нь өөр өөр байж болно тохиргоо (тохиргооны изомерууд) эсвэл зохицол (конформацийн изомерууд).
Тохиргоо- хирал төв, давхар бондын хавтгай эсвэл цагирагийн хавтгайн эргэн тойронд атом ба/эсвэл атомын бүлгүүдийн орон зайн байрлал, тодорхой стереоизомерыг тодорхойлдог. Энэ ойлголт нь үндсэндээ чанарын шинж чанартай бөгөөд тухайн молекулын хирал төвийн эргэн тойрон дахь орон зай дахь атомуудын өвөрмөц зохицуулалтын стереохимийн шинж чанарыг тусгасан байдаг.
Тохируулгын изомерууд болох хос нэгдлүүдийг доор үзүүлэв.

Зохицуулалт*- энгийн бондын эргэн тойронд атом эсвэл атомын бүлгүүдийн дотоод эргэлтээс үүдэлтэй молекулын тодорхой геометр. Энэ тохиолдолд молекулын стереохимийн тохиргоо өөрчлөгдөөгүй хэвээр байна.
Ньюманы проекцийг конформацийг дүрслэхийн тулд ашигладаг. Этаны хувьд хоёр хилийн хэлбэр боломжтой: хиртсэн (I) ба дарангуйлагдсан (II).

Бутан нь этанаас хоёр метилийн бүлэг байдгаараа ялгаатай тул доор үзүүлсэн шиг энэ молекулын хувьд илүү олон тооны дарангуйлагдсан конформаци үүсэх боломжтой. I-ийн илүү тогтвортой хэлбэрийг дараах байдлаар тэмдэглэв эсрэг: энд метилийн бүлгүүд бие биенээсээ аль болох хол зайд байрладаг (диэдр өнцөг нь 180 o). Нөгөө хоёр хэлбэр нь ташуу, эсвэл өөрөөр хэлбэл гауш хэлбэрийн (II ба III) бөгөөд метилийн бүлгүүд нь 60 ° өнцгийг үүсгэдэг.

