प्रक्षेपण सूत्र. फिशर प्रक्षेपण सूत्र. सापेक्ष डी- और एल स्टीरियोकेमिकल नामकरण की एक प्रणाली है। स्टीरियोइसोमर्स का पूर्ण विन्यास। अन्य प्रकार के वैकल्पिक रूप से सक्रिय पदार्थ
साथकार्बनिक यौगिकों में ऐसे पदार्थ हैं जो प्रकाश के ध्रुवीकरण के तल को घुमा सकते हैं। इस घटना को ऑप्टिकल गतिविधि कहा जाता है, और संबंधित पदार्थ हैं दृष्टिगत रूप से सक्रिय. प्रकाशिक रूप से सक्रिय पदार्थ जोड़े में होते हैं ऑप्टिकल एंटीपोड- आइसोमर्स, जिनके भौतिक और रासायनिक गुण सामान्य परिस्थितियों में समान होते हैं, एक चीज के अपवाद के साथ - ध्रुवीकरण के विमान के घूर्णन का संकेत: ऑप्टिकल एंटीपोड्स में से एक ध्रुवीकरण के विमान को दाईं ओर विक्षेपित करता है (+, डेक्सट्रोटोटरी आइसोमर), बाईं ओर दूसरा (-, लेवोरोटेटरी)।
ऑप्टिकल आइसोमेरिज्म तब प्रकट होता है जब अणु में शामिल होता है असममित कार्बन परमाणु. यह चार अलग-अलग प्रतिस्थापनों से बंधे कार्बन परमाणु को दिया गया नाम है। एक असममित परमाणु के चारों ओर प्रतिस्थापकों की दो चतुष्फलकीय व्यवस्थाएँ संभव हैं। दोनों स्थानिक रूपों को किसी भी घुमाव द्वारा संयोजित नहीं किया जा सकता है; उनमें से एक दूसरे की दर्पण छवि है।
समावयवता के जिस प्रकार पर विचार किया जाता है उसे कहते हैं ऑप्टिकल समरूपता
, दर्पण समरूपता
या enantiomerism
. दोनों दर्पण रूप ऑप्टिकल एंटीपोड या की एक जोड़ी बनाते हैं एनंटीओमर
.
स्थानिक आइसोमर्स की संख्या फिशर सूत्र एन = 2 एन द्वारा निर्धारित की जाती है, जहां एन असममित केंद्रों की संख्या है।
प्रक्षेपण सूत्र
एक समतल पर एक असममित परमाणु को पारंपरिक रूप से चित्रित करने के लिए, इसका उपयोग करें ई. फिशर के प्रक्षेपण सूत्र. वे उन परमाणुओं को एक तल पर प्रक्षेपित करके प्राप्त किए जाते हैं जिनसे असममित परमाणु जुड़ा होता है। इस मामले में, असममित परमाणु को आमतौर पर छोड़ दिया जाता है, केवल प्रतिच्छेदी रेखाओं और स्थानापन्न प्रतीकों को बरकरार रखा जाता है। प्रतिस्थापनों की स्थानिक व्यवस्था को याद रखने के लिए, एक टूटी हुई ऊर्ध्वाधर रेखा को अक्सर प्रक्षेपण सूत्रों में संरक्षित किया जाता है (ऊपरी और निचले प्रतिस्थापनों को ड्राइंग के विमान से परे हटा दिया जाता है), लेकिन ऐसा अक्सर नहीं किया जाता है। पिछले चित्र में बाएँ मॉडल के अनुरूप प्रक्षेपण सूत्र लिखने के विभिन्न तरीके नीचे दिए गए हैं:

यहां प्रक्षेपण सूत्रों के कुछ उदाहरण दिए गए हैं:

पदार्थों के नाम उनके घूर्णन चिन्ह दर्शाते हैं। इसका मतलब है, उदाहरण के लिए, कि ब्यूटेनॉल-2 के बाएं हाथ के एंटीपोड में एक स्थानिक विन्यास है जो उपरोक्त सूत्र द्वारा सटीक रूप से व्यक्त किया गया है, और इसकी दर्पण छवि दाएं हाथ के ब्यूटेनॉल-2 से मेल खाती है। ऑप्टिकल एंटीपोड का विन्यास प्रयोगात्मक रूप से निर्धारित किया जाता है।
दोनों प्रतिपदों की समान मात्रा से युक्त मिश्रण कहलाता है रेसमेट. यह प्रकाशिक रूप से निष्क्रिय है और इसमें भौतिक स्थिरांक के उत्कृष्ट मान हैं।
सिद्धांत रूप में, प्रत्येक ऑप्टिकल एंटीपोड को बारह (!) विभिन्न प्रक्षेपण सूत्रों द्वारा चित्रित किया जा सकता है - यह इस पर निर्भर करता है कि प्रक्षेपण का निर्माण करते समय मॉडल कैसे स्थित है, हम इसे किस तरफ से देखते हैं। प्रक्षेपण सूत्रों को मानकीकृत करने के लिए, उन्हें लिखने के लिए कुछ नियम पेश किए गए हैं। इस प्रकार, मुख्य कार्य, यदि यह श्रृंखला के अंत में है, आमतौर पर शीर्ष पर रखा जाता है, मुख्य श्रृंखला को लंबवत रूप से दर्शाया जाता है।
प्रक्षेपण सूत्रों को परिवर्तित करने के नियम:
1. सूत्रों को उनके स्टीरियोकेमिकल अर्थ को बदले बिना ड्राइंग प्लेन में 180° घुमाया जा सकता है:

2. एक असममित परमाणु पर प्रतिस्थापनों की दो (या कोई भी सम संख्या) पुनर्व्यवस्था सूत्र के त्रिविम रासायनिक अर्थ को नहीं बदलती है:

3. असममित केंद्र पर प्रतिस्थापकों का एक (या कोई विषम संख्या) क्रमपरिवर्तन ऑप्टिकल एंटीपोड के सूत्र की ओर ले जाता है:

4. ड्राइंग प्लेन में 90° का घुमाव सूत्र को एंटीपोड में बदल देता है, जब तक कि उसी समय ड्राइंग प्लेन के सापेक्ष प्रतिस्थापनों के स्थान की स्थिति नहीं बदल जाती, यानी। इस बात पर विचार न करें कि अब पार्श्व प्रतिस्थापन ड्राइंग विमान के पीछे स्थित हैं, और ऊपरी और निचले वाले इसके सामने हैं। यदि आप बिंदीदार रेखा वाले सूत्र का उपयोग करते हैं, तो बिंदीदार रेखा का बदला हुआ अभिविन्यास आपको सीधे इसकी याद दिलाएगा:

5. क्रमपरिवर्तन के बजाय, किन्हीं तीन प्रतिस्थापनों को दक्षिणावर्त या वामावर्त घुमाकर प्रक्षेपण सूत्रों को रूपांतरित किया जा सकता है; चौथा स्थानापन्न अपनी स्थिति नहीं बदलता है (यह ऑपरेशन दो क्रमपरिवर्तन के बराबर है):

6. प्रक्षेपण सूत्र ड्राइंग तल से प्राप्त नहीं किए जा सकते।
अन्य प्रकार के वैकल्पिक रूप से सक्रिय पदार्थ
यह खंड कार्बनिक यौगिकों के कुछ अन्य वर्गों को सूचीबद्ध करता है जो ऑप्टिकल गतिविधि भी प्रदर्शित करते हैं (यानी, ऑप्टिकल एंटीपोड के जोड़े के रूप में विद्यमान)।
कार्बनिक यौगिकों के अणुओं में चिरल केंद्रों के निर्माण पर कार्बन परमाणु का एकाधिकार नहीं है। चिरैलिटी का केंद्र चतुर्धातुक अमोनियम लवण और तृतीयक अमाइन ऑक्साइड में सिलिकॉन, टिन और टेट्राकोवैलेंट नाइट्रोजन परमाणु भी हो सकते हैं:

इन यौगिकों में, असममिति के केंद्र में असममित कार्बन परमाणु की तरह टेट्राहेड्रल विन्यास होता है। हालाँकि, चिरल केंद्र की एक अलग स्थानिक संरचना वाले यौगिक भी हैं।
पिरामिडविन्यास त्रिसंयोजक नाइट्रोजन, फास्फोरस, आर्सेनिक, सुरमा और सल्फर के परमाणुओं द्वारा निर्मित चिरल केंद्र है। सिद्धांत रूप में, विषमता के केंद्र को टेट्राहेड्रल माना जा सकता है यदि हेटरोएटोम की अकेली इलेक्ट्रॉन जोड़ी को चौथे प्रतिस्थापन के रूप में लिया जाता है:

ऑप्टिकल गतिविधि भी हो सकती है बिना चिरल केंद्र, समग्र रूप से संपूर्ण अणु की संरचना की चिरलिटी के कारण ( आणविक चिरायता या आणविक विषमता ). सबसे विशिष्ट उदाहरण उपस्थिति हैं चिरल अक्ष या चिरल विमान .
उदाहरण के लिए, चिरल अक्ष विभिन्न प्रतिस्थापन वाले एलीन्स में प्रकट होता है एसपी 2-हाइब्रिड कार्बन परमाणु. यह देखना आसान है कि नीचे दिए गए यौगिक असंगत दर्पण छवियां हैं, और इसलिए ऑप्टिकल एंटीपोड हैं:

चिरल अक्ष वाले यौगिकों का एक अन्य वर्ग ऑप्टिकली सक्रिय बाइफिनाइल है, जो है ऑर्थो-स्थितियों में भारी पदार्थ होते हैं जो बेंजीन रिंगों को जोड़ने वाले सी-सी बांड के चारों ओर मुक्त घूर्णन में बाधा डालते हैं:

चिरल विमानइसकी विशेषता यह है कि इसे "ऊपर" और "नीचे", साथ ही "दाएँ" और "बाएँ" पक्षों के बीच प्रतिष्ठित किया जा सकता है। किरल प्लेन वाले यौगिकों का एक उदाहरण ऑप्टिकली सक्रिय है ट्रान्स-साइक्लोएक्टीन और वैकल्पिक रूप से सक्रिय फेरोसीन व्युत्पन्न:

डायस्टेरोमेरिज़्म
कई असममित परमाणुओं वाले यौगिकों में महत्वपूर्ण विशेषताएं होती हैं जो उन्हें असममिति के एक केंद्र के साथ पहले चर्चा किए गए सरल ऑप्टिकली सक्रिय पदार्थों से अलग करती हैं।
आइए मान लें कि एक निश्चित पदार्थ के अणु में दो असममित परमाणु हैं; आइए हम उन्हें सशर्त रूप से ए और बी के रूप में निरूपित करें। यह देखना आसान है कि निम्नलिखित संयोजन वाले अणु संभव हैं (एन = 2 2 = 4):
अणु 1 और 2 ऑप्टिकल एंटीपोड की एक जोड़ी हैं; यही बात अणुओं 3 और 4 की जोड़ी पर भी लागू होती है। यदि हम एंटीपोड के विभिन्न जोड़े - 1 और 3, 1 और 4, 2 और 3, 2 और 4 - के अणुओं की एक दूसरे से तुलना करते हैं, तो हम देखेंगे कि सूचीबद्ध जोड़े ऑप्टिकल एंटीपोड नहीं हैं: एक असममित परमाणु का विन्यास समान है, दूसरे का विन्यास समान नहीं है। ये जोड़े हैं डायस्टेरोमर्स , अर्थात। स्थानिक आइसोमर्स, नहीं एक दूसरे के साथ ऑप्टिकल एंटीपोड का गठन।
डायस्टेरेओमर्स न केवल ऑप्टिकल रोटेशन में, बल्कि अन्य सभी भौतिक स्थिरांकों में भी एक-दूसरे से भिन्न होते हैं: उनके अलग-अलग पिघलने और क्वथनांक, अलग-अलग घुलनशीलताएं आदि होते हैं। डायस्टेरेओमर्स के गुणों में अंतर अक्सर संरचनात्मक आइसोमर्स के बीच गुणों के अंतर से कम नहीं होता है। .
इस प्रकार के यौगिक का एक उदाहरण क्लोरोमालिक एसिड (2 अलग-अलग चिरल केंद्र) होगा:

इसके स्टीरियोइसोमेरिक रूपों में निम्नलिखित प्रक्षेपण सूत्र हैं:

| एरिथ्रो-रूप | त्रि-रूप |
टाइटल एरिथ्रो- और तिकड़ी- कार्बोहाइड्रेट एरिथ्रोस और थ्रोस के नाम से आते हैं। इन नामों का उपयोग दो असममित परमाणुओं वाले यौगिकों में प्रतिस्थापनों की सापेक्ष स्थिति को इंगित करने के लिए किया जाता है: एरिथ्रो -आइसोमर्स वे होते हैं जिनमें दो समान पार्श्व प्रतिस्थापन एक तरफ मानक प्रक्षेपण सूत्र में दिखाई देते हैं (दाएं या बाएं, अक्षर ई के दो छोर); तिकड़ी -आइसोमर्स के प्रक्षेपण सूत्र के विभिन्न पक्षों पर समान पार्श्व प्रतिस्थापन होते हैं। दो एरिथ्रो-आइसोमर्स ऑप्टिकल एंटीपोड्स की एक जोड़ी हैं; जब वे मिश्रित होते हैं, तो एक रेसमेट बनता है। ऑप्टिकल आइसोमर्स की एक जोड़ी हैं और तीन-रूप; मिश्रित होने पर वे रेसमेट भी बनाते हैं, जो रेसमेट से गुणों में भिन्न होता है एरिथ्रो-प्रपत्र. इस प्रकार, क्लोरोमालिक एसिड के कुल चार वैकल्पिक रूप से सक्रिय आइसोमर्स और दो रेसमेट्स हैं।
कुछ संरचनाओं में आंशिक समरूपता दिखाई देने के कारण स्टीरियोइसोमर्स की संख्या घट सकती है। एक उदाहरण टार्टरिक एसिड है, जिसमें व्यक्तिगत स्टीरियोइसोमर्स की संख्या तीन तक कम हो जाती है। उनके प्रक्षेपण सूत्र:

| मैं | मैं एक | द्वितीय | तृतीय |
फॉर्मूला I, फॉर्मूला Ia के समान है, क्योंकि यह ड्राइंग के तल में 180° घुमाने पर इसमें परिवर्तित हो जाता है और इसलिए, एक नए स्टीरियोआइसोमर का प्रतिनिधित्व नहीं करता है। इसे वैकल्पिक रूप से निष्क्रिय संशोधन कहा जाता है मेसो फॉर्म . सभी वैकल्पिक रूप से सक्रिय पदार्थों में कई समान (यानी, समान प्रतिस्थापन से जुड़े) असममित केंद्रों के साथ मेसो रूप होते हैं। मेसो-रूपों के प्रक्षेपण सूत्रों को हमेशा इस तथ्य से पहचाना जा सकता है कि उन्हें एक क्षैतिज रेखा द्वारा दो हिस्सों में विभाजित किया जा सकता है, जो कागज पर लिखे जाने पर औपचारिक रूप से समान होते हैं, लेकिन वास्तव में प्रतिबिंबित होते हैं (आंतरिक समरूपता का तल):

सूत्र II और III टार्टरिक एसिड के ऑप्टिकल एंटीपोड को दर्शाते हैं; जब उन्हें मिलाया जाता है, तो एक वैकल्पिक रूप से निष्क्रिय रेसमेट बनता है - अंगूर एसिड।
ऑप्टिकल आइसोमर्स का नामकरण
ऑप्टिकल एंटीपोड के नामकरण की सबसे सरल, सबसे पुरानी, लेकिन अभी भी उपयोग में आने वाली प्रणाली "कुंजी" के रूप में चुने गए एक निश्चित मानक पदार्थ के प्रक्षेपण सूत्र के साथ तथाकथित एंटीपोड के प्रक्षेपण सूत्र की तुलना पर आधारित है। इस प्रकार, α-हाइड्रॉक्सी एसिड और α-एमिनो एसिड के लिए, कुंजी उनके प्रक्षेपण सूत्र का ऊपरी भाग है (मानक नोटेशन में):

मानक लिखित फिशर प्रक्षेपण सूत्र में बाईं ओर हाइड्रॉक्सिल समूह वाले सभी α-हाइड्रॉक्सी एसिड का विन्यास संकेत द्वारा दर्शाया गया है एल; यदि हाइड्रॉक्सिल दाहिनी ओर प्रक्षेपण सूत्र में स्थित है - चिह्न डी
यौगिकों के विन्यास को निर्दिष्ट करने की कुंजी ग्लिसराल्डिहाइड है:

चीनी अणुओं में पदनाम डी-या एलकॉन्फ़िगरेशन को संदर्भित करता है निचलाअसममित केंद्र.
प्रणाली डी-,एलपदनाम में महत्वपूर्ण कमियां हैं: सबसे पहले, पदनाम डी-या एलकेवल एक असममित परमाणु के विन्यास को इंगित करता है; दूसरे, कुछ यौगिकों के लिए अलग-अलग प्रतीक प्राप्त होते हैं, यह इस बात पर निर्भर करता है कि ग्लिसराल्डिहाइड या हाइड्रॉक्सीएसिड कुंजी को कुंजी के रूप में लिया गया है या नहीं, उदाहरण के लिए:

मुख्य प्रणाली की ये कमियाँ वर्तमान में इसके उपयोग को वैकल्पिक रूप से सक्रिय पदार्थों के तीन वर्गों तक सीमित करती हैं: शर्करा, अमीनो एसिड और हाइड्रॉक्सी एसिड। सामान्य उपयोग के लिए डिज़ाइन किया गया आर,एस-प्रणाली कहन, इंगोल्ड और प्रीलॉग।
ऑप्टिकल एंटीपोड के आर- या एस-कॉन्फ़िगरेशन को निर्धारित करने के लिए, असममित कार्बन परमाणु के चारों ओर प्रतिस्थापन के टेट्राहेड्रोन को इस तरह से व्यवस्थित करना आवश्यक है कि सबसे कम प्रतिस्थापन (आमतौर पर हाइड्रोजन) की दिशा "पर्यवेक्षक से दूर" हो। यदि वरिष्ठता में सबसे बड़े से मध्य तक और फिर सबसे छोटे तक तीन शेष प्रतिनिधियों के एक सर्कल में संक्रमण के दौरान आंदोलन होता है वामावर्त - यह एस -आइसोमर (अक्षर एस लिखते समय हाथ की समान गति से जुड़ा हुआ), यदि दक्षिणावर्त - यह आर- आइसोमर (अक्षर आर लिखते समय हाथ की गति से जुड़ा हुआ)।
एक असममित परमाणु पर प्रतिस्थापनों की वरिष्ठता निर्धारित करने के लिए, परमाणु संख्याओं की गणना के नियमों का उपयोग किया जाता है, जिन पर हम पहले ही ज्यामितीय आइसोमर्स के Z,E नामकरण के संबंध में चर्चा कर चुके हैं।
प्रक्षेपण सूत्र के अनुसार आर, एस-नोटेशन का चयन करने के लिए, समान संख्या में क्रमपरिवर्तन (जो, जैसा कि हम जानते हैं, सूत्र के स्टीरियोकेमिकल अर्थ को नहीं बदलते हैं) द्वारा प्रतिस्थापनों को व्यवस्थित करना आवश्यक है ताकि सबसे छोटा वे (आमतौर पर हाइड्रोजन) प्रक्षेपण सूत्र के निचले भाग में होते हैं। फिर शेष तीन प्रतिस्थापनों की वरिष्ठता, दक्षिणावर्त गिरते हुए, पदनाम आर से मेल खाती है, वामावर्त - पदनाम एस:

कार्बनिक यौगिकों की संरचना के बारे में आधुनिक विचार। कार्बनिक यौगिकों की स्टीरियोकैमिस्ट्री के मूल सिद्धांत। असममित कार्बन परमाणु. चिरायता. फिशर प्रक्षेपण सूत्र.
रासायनिक संरचना का सिद्धांत ए.एम. बटलरोव
1861 में ए.एम. बटलरोव ने कार्बनिक यौगिकों की रासायनिक संरचना का एक सिद्धांत प्रस्तावित किया, जिसमें निम्नलिखित बुनियादी सिद्धांत शामिल हैं।
1) पदार्थों के अणुओं में परमाणुओं के रासायनिक बंधन का एक सख्त क्रम होता है, जिसे रासायनिक संरचना कहा जाता है।
2) किसी पदार्थ के रासायनिक गुण उसके प्राथमिक घटकों की प्रकृति, उनकी मात्रा और रासायनिक संरचना से निर्धारित होते हैं।
3) यदि समान संरचना और आणविक भार वाले पदार्थों की संरचना अलग-अलग हो, तो समावयवता की घटना घटित होती है।
4) चूंकि विशिष्ट प्रतिक्रियाओं में अणु के केवल कुछ हिस्से बदलते हैं, उत्पाद की संरचना का अध्ययन करने से मूल अणु की संरचना निर्धारित करने में मदद मिलती है।
5) एक अणु में व्यक्तिगत परमाणुओं की रासायनिक प्रकृति (प्रतिक्रियाशीलता) पर्यावरण के आधार पर बदलती है, अर्थात। यह इस पर निर्भर करता है कि वे अन्य तत्वों के किन परमाणुओं से जुड़े हैं।
बटलरोव का सिद्धांत रासायनिक गुणों (स्थूल गुणों) के ज्ञान के माध्यम से एक अणु की ज्यामिति (सूक्ष्म गुण) को जानने की मौलिक संभावना प्रदान करता है। संरचना के सिद्धांत के मूल सिद्धांत आज भी अपना महत्व बरकरार रखते हैं।
रासायनिक बंधन के इलेक्ट्रॉनिक सिद्धांत.
कार्बनिक यौगिकों की इलेक्ट्रॉनिक संरचना को लुईस इलेक्ट्रॉन सूत्रों का उपयोग करके दर्शाया गया है। वे सभी वैलेंस इलेक्ट्रॉनों की स्थिति को इंगित करने के लिए बिंदुओं का उपयोग करते हैं: रासायनिक बांड के इलेक्ट्रॉन और इलेक्ट्रॉनों के एकाकी जोड़े। ऐसा माना जाता है कि इलेक्ट्रॉनों के एकाकी जोड़े केवल एक परमाणु के बाहरी आवरण का हिस्सा होते हैं, और सहसंयोजक बंधन के निर्माण में शामिल इलेक्ट्रॉन दोनों परमाणुओं के बाहरी आवरण का हिस्सा होते हैं। उदाहरण के लिए, नीचे दिए गए कार्बन टेट्राक्लोराइड के लुईस सूत्र में, सभी परमाणुओं में इलेक्ट्रॉनों का एक अष्टक होता है।
लुईस संरचना में प्रत्येक परमाणु के लिए, एक औपचारिक शुल्क निर्धारित किया जाता है। ऐसा माना जाता है कि परमाणु सभी असंबद्ध इलेक्ट्रॉनों और सहसंयोजक बंधों में आधे इलेक्ट्रॉनों का मालिक है। एक मुक्त परमाणु की तुलना में एक अणु में परमाणु से संबंधित इलेक्ट्रॉनों की अधिकता नकारात्मक चार्ज का कारण बनती है, और कमी एक सकारात्मक चार्ज का कारण बनती है। सभी परमाणुओं के औपचारिक आवेशों का योग समग्र रूप से कण का आवेश देता है।

क्वांटम कार्बनिक रसायन विज्ञान के मूल सिद्धांत।

सहसंयोजक बंधों के आधुनिक सिद्धांत क्वांटम यांत्रिकी की अवधारणाओं पर आधारित हैं। क्वांटम यांत्रिकी के सिद्धांतों के अनुसार, एक परमाणु में एक इलेक्ट्रॉन की स्थिति एक तरंग फ़ंक्शन द्वारा निर्धारित होती है जिसे परमाणु कक्षक कहा जाता है। परमाणुओं के बीच रासायनिक बंधन का निर्माण दो ऑर्बिटल्स की परस्पर क्रिया का परिणाम माना जाता है, जिनमें से प्रत्येक में एक इलेक्ट्रॉन होता है। इस मामले में, आणविक कक्षा (एमओ) का निर्माण होता है। दो परमाणु कक्षकों से दो आणविक कक्षक बनते हैं, जिनमें से एक ( कनेक्ट) में कम ऊर्जा होती है, और दूसरा ( ढीला) - मूल एओ की तुलना में उच्च ऊर्जा।
बॉन्डिंग इलेक्ट्रॉन निम्न ऊर्जा बॉन्डिंग ऑर्बिटल पर कब्जा कर लेते हैं, इसलिए ऑर्बिटल्स की परस्पर क्रिया के परिणामस्वरूप ऊर्जा लाभ होता है।

संयोजित होने वाले परमाणु कक्षकों के प्रकार के आधार पर, विभिन्न प्रकार के एमओ बनते हैं। ऑर्बिटल्स की समरूपता और नोडल गुण इसमें निर्णायक भूमिका निभाते हैं। परमाणुएस -ऑर्बिटल्स में गोलाकार समरूपता होती है और परमाणु के केंद्र से गुजरने वाली नोडल सतह नहीं होती है। परमाणुपी -ऑर्बिटल्स में बेलनाकार समरूपता और तीन अवस्थाएँ होती हैंपी एक्स, पी वाई और पी जेड। प्रत्येक प -ऑर्बिटल में एक नोडल प्लेन होता है जो क्रमशः परमाणु के केंद्र और अक्ष के लंबवत से होकर गुजरता हैएक्स, वाई या जेड.
नोडल सतह वह स्थान है जहां इलेक्ट्रॉन मिलने की संभावना शून्य होती है और तरंग फ़ंक्शन संकेत बदलता है। जितने अधिक नोड होंगे, कक्षक की ऊर्जा उतनी ही अधिक होगी। इस प्रकार,पी -ऑर्बिटल में दो भाग होते हैं जिनमें तरंग कार्यों के संकेत विपरीत होते हैं।
बहुपरमाणुक अणुओं की इलेक्ट्रॉनिक संरचना पर विचार करते समय, ऑर्बिटल्स के एक सेट का उपयोग करना आवश्यक है जो उनके अधिकतम ओवरलैप को प्राप्त करता है। इस संबंध में एक अवधारणा है संकरण कक्षाएँ। उत्तेजित अवस्था में एक कार्बन परमाणु के बाहरी ऊर्जा स्तर में चार अयुग्मित इलेक्ट्रॉन होते हैं और यह चार सहसंयोजक बंधन बनाने में सक्षम होता है।
हाइब्रिड ऑर्बिटल्स बांड के निर्माण में भाग लेते हैं।
पहली संयोजकता अवस्था एसपी 3 संकरण है . कार्बन परमाणु के एक एस और तीन पी ऑर्बिटल्स की भागीदारी के साथ संकरण के परिणामस्वरूप, चार समकक्ष एसपी 3-हाइब्रिड ऑर्बिटल्स बनते हैं, जो 109.5 ओ के कोण पर टेट्राहेड्रोन के शीर्ष पर निर्देशित होते हैं:
एसपी 3 संकरण की अवस्था में कार्बन परमाणु चार बनाता हैएस-चार प्रतिस्थापकों वाला बंधन और 109.5 o के बराबर या उसके करीब बंधन कोणों के साथ चतुष्फलकीय विन्यास होता है:

मीथेन
दूसरी संयोजकता अवस्था एसपी 2 संकरण है . कार्बन परमाणु के एक एस- और दो पी-ऑर्बिटल्स की भागीदारी के साथ संकरण के परिणामस्वरूप, तीन समकक्ष एसपी 2-हाइब्रिड ऑर्बिटल्स बनते हैं, जो 120 ओ के कोण पर एक ही विमान में स्थित होते हैं, और पी-ऑर्बिटल भाग नहीं लेते हैं संकरण में संकर कक्षकों के तल के लंबवत स्थित होता है।
एसपी 2 संकरण की अवस्था में कार्बन परमाणु तीन बनाता हैएस-हाइब्रिड ऑर्बिटल्स और एक के कारण बंधनपी-बंधन पी-ऑर्बिटल के संकरण में भाग नहीं लेने के कारण होता है और इसमें तीन स्थानापन्न होते हैं।
कार्बन की तीसरी संयोजकता अवस्था एसपी-संकरण है . एक एस- और एक पी-ऑर्बिटल की भागीदारी के साथ संकरण के परिणामस्वरूप, दो समकक्ष एसपी-हाइब्रिड ऑर्बिटल्स बनते हैं, जो 180 0 के कोण पर स्थित होते हैं, और संकरण में भाग नहीं लेने वाले पी-ऑर्बिटल्स विमान के लंबवत स्थित होते हैं। संकर कक्षकों का और एक दूसरे का। एसपी-संकरण अवस्था में, कार्बन परमाणु दो बनाता हैएस-हाइब्रिड ऑर्बिटल्स और दो के कारण बंधनपी-पी-ऑर्बिटल्स के संकरण में भाग नहीं लेने के कारण बंधन और इसके दो प्रतिस्थापन हैं:

एसिटिलीन
स्टीरियोकेमिस्ट्री की मूल बातें।
स्टीरियोकेमिस्ट्री रसायन विज्ञान का एक हिस्सा है जो अणुओं की स्थानिक संरचना और किसी पदार्थ के भौतिक और रासायनिक गुणों, उनकी प्रतिक्रियाओं की दिशा और दर पर इस संरचना के प्रभाव के अध्ययन के लिए समर्पित है।
अनुरूपता (घूर्णी समरूपता)।
सबसे सरल कार्बनिक हाइड्रोकार्बन, मीथेन से उसके निकटतम समरूप, ईथेन में संक्रमण, स्थानिक संरचना की समस्याएं पैदा करता है, जिसके समाधान के लिए पहले चर्चा किए गए मापदंडों को जानना पर्याप्त नहीं है। बंधन कोणों या बंधन लंबाई को बदले बिना, कोई ईथेन अणु के कई ज्यामितीय आकृतियों की कल्पना कर सकता है, जो उन्हें जोड़ने वाले सी-सी बंधन के चारों ओर कार्बन टेट्राहेड्रा के पारस्परिक घूर्णन में एक दूसरे से भिन्न होते हैं। इस घूर्णन के परिणामस्वरूप, रोटरी आइसोमर्स (कन्फर्मर्स) . विभिन्न कन्फर्मर्स की ऊर्जा समान नहीं होती है, लेकिन विभिन्न रोटरी आइसोमर्स को अलग करने वाली ऊर्जा बाधा अधिकांश कार्बनिक यौगिकों के लिए छोटी होती है। इसलिए, सामान्य परिस्थितियों में, एक नियम के रूप में, अणुओं को एक कड़ाई से परिभाषित संरचना में ठीक करना असंभव है। आमतौर पर, कई घूर्णी रूप जो आसानी से एक-दूसरे में बदल जाते हैं, संतुलन में सह-अस्तित्व में रहते हैं।
आइए अनुरूपताओं और उनके नामकरण को ग्राफिक रूप से प्रस्तुत करने के तरीकों पर विचार करें। ईथेन अणु के लिए, कोई दो अनुरूपताओं के अस्तित्व की भविष्यवाणी कर सकता है जो ऊर्जा में अधिकतम भिन्न हैं। उन्हें नीचे इस प्रकार दर्शाया गया है परिप्रेक्ष्य अनुमान (1) ("आरा मिल बकरियाँ"), पार्श्व प्रक्षेपण (2) और न्यूमैन के सूत्र .

बायीं ओर दिखाई गई रचना कहलाती है अस्पष्ट . यह नाम हमें याद दिलाता है कि दोनों CH3 समूहों के हाइड्रोजन परमाणु एक दूसरे के विपरीत हैं। ग्रहण की संरचना ने आंतरिक ऊर्जा में वृद्धि की है और इसलिए प्रतिकूल है। दाहिनी ओर दिखाई गई रचना कहलाती है संकोची , जिसका अर्थ है कि इस स्थिति में सी-सी बांड के चारों ओर मुक्त घुमाव "अवरुद्ध" है, अर्थात। अणु मुख्य रूप से इस संरचना में मौजूद होता है।
जैसे-जैसे अणु अधिक जटिल होता जाता है, संभावित अनुरूपताओं की संख्या बढ़ती जाती है। इसके लिए हां एन-ब्यूटेन को पहले से ही छह अनुरूपताओं में दर्शाया जा सकता है, जो सीएच 3 समूहों की सापेक्ष व्यवस्था में भिन्न है, यानी। केंद्रीय कनेक्शन सी-सी के चारों ओर घूमना। नीचे, एन-ब्यूटेन की संरचना को न्यूमैन अनुमानों के रूप में दर्शाया गया है। बाईं ओर दिखाई गई अनुरूपताएं (छायांकित) ऊर्जावान रूप से प्रतिकूल हैं; केवल बाधित लोगों को ही व्यावहारिक रूप से महसूस किया जाता है।

ब्यूटेन की विभिन्न ग्रहणशील और बाधित रचनाएँ ऊर्जा में समान नहीं हैं। केंद्रीय सी-सी बंधन के चारों ओर घूमने के दौरान गठित सभी अनुरूपताओं की संगत ऊर्जा।
तो, अनुरूपण एक अणु के विभिन्न स्थानिक रूप हैं जिनका एक निश्चित विन्यास होता है। कंफर्मर्स स्टीरियोइसोमेरिक संरचनाएं हैं जो संभावित ऊर्जा आरेख पर ऊर्जा मिनिमा के अनुरूप हैं, मोबाइल संतुलन में हैं और सरल बांडों के चारों ओर घूमकर अंतर-रूपांतरित करने में सक्षम हैं।
कभी-कभी ऐसे परिवर्तनों में बाधा इतनी अधिक हो जाती है कि स्टीरियोइसोमेरिक रूपों को अलग किया जा सके (उदाहरण के लिए, ऑप्टिकली सक्रिय बाइफिनाइल)। ऐसे मामलों में, वे अब अनुरूपकर्ताओं के बारे में बात नहीं करते हैं, बल्कि वास्तव में मौजूदा लोगों के बारे में बात करते हैं स्टीरियोआइसोमर .
ज्यामितीय समरूपता.
दोहरे बंधन की कठोरता (इसके चारों ओर घूमने की अनुपस्थिति) का एक महत्वपूर्ण परिणाम अस्तित्व है ज्यामितीय आइसोमर्स . उनमें से सबसे आम हैं सीआईएस-, ट्रांस-आइसोमर्स एथिलीन श्रृंखला के यौगिक जिनमें असंतृप्त परमाणुओं पर असमान पदार्थ होते हैं। सबसे सरल उदाहरण ब्यूटेन-2 के आइसोमर्स हैं।

ज्यामितीय आइसोमर्स की रासायनिक संरचना समान होती है, जो परमाणुओं की स्थानिक व्यवस्था में भिन्न होती है, अर्थात। द्वारा विन्यास . यह अंतर भौतिक (साथ ही रासायनिक) गुणों में अंतर पैदा करता है। ज्यामितीय आइसोमर्स, कन्फर्मर्स के विपरीत, शुद्ध रूप में अलग किए जा सकते हैं और व्यक्तिगत स्थिर पदार्थों के रूप में मौजूद हो सकते हैं। उनके पारस्परिक परिवर्तन के लिए, 125-170 kJ/mol के क्रम की ऊर्जा की आवश्यकता होती है, जिसे हीटिंग या विकिरण द्वारा प्रदान किया जा सकता है।
सरलतम मामलों में, ज्यामितीय आइसोमर्स का नामकरण कोई कठिनाई पेश नहीं करता है: सीआईएस- रूप ज्यामितीय आइसोमर्स हैं जिनमें समान पदार्थ पाई बांड विमान के एक ही तरफ स्थित होते हैं, ट्रान्स- पाई बांड तल के विभिन्न पक्षों पर आइसोमर्स के समान प्रतिस्थापन होते हैं। अधिक जटिल मामलों में इसका उपयोग किया जाता है जेड,ई-नामकरण . इसका मुख्य सिद्धांत: कॉन्फ़िगरेशन को इंगित करना इंगित करना है सीआईएस-(Z, जर्मन ज़ुसामेन से - एक साथ) या ट्रान्स-(ई, जर्मन एंटगेजेन से - विपरीत) स्थान वरिष्ठ प्रतिनिधि दोहरे बंधन के साथ.
Z,E प्रणाली में, उच्च परमाणु क्रमांक वाले प्रतिस्थापकों को वरिष्ठ माना जाता है। यदि असंतृप्त कार्बन से सीधे जुड़े परमाणु समान हैं, तो वे "दूसरी परत" पर चले जाते हैं, यदि आवश्यक हो - "तीसरी परत" आदि पर।
3. ऑप्टिकल आइसोमेरिज्म (एनैन्टीओमेरिज्म)।
कार्बनिक यौगिकों में ऐसे पदार्थ हैं जो प्रकाश के ध्रुवीकरण के तल को घुमा सकते हैं। इस घटना को ऑप्टिकल गतिविधि कहा जाता है, और संबंधित पदार्थों को कहा जाता है दृष्टिगत रूप से सक्रिय . प्रकाशिक रूप से सक्रिय पदार्थ जोड़े में होते हैं ऑप्टिकल एंटीपोड - आइसोमर्स, जिनके भौतिक और रासायनिक गुण सामान्य परिस्थितियों में समान होते हैं, एक चीज के अपवाद के साथ - ध्रुवीकरण के विमान के घूर्णन का संकेत। (यदि ऑप्टिकल एंटीपोड में से एक में, उदाहरण के लिए, +20 o का एक विशिष्ट घुमाव है, तो दूसरे में -20 o का एक विशिष्ट घुमाव है)।
प्रक्षेपण सूत्र.
एक समतल पर एक असममित परमाणु को पारंपरिक रूप से चित्रित करने के लिए, इसका उपयोग करें ई. फिशर के प्रक्षेपण सूत्र . वे उन परमाणुओं को एक तल पर प्रक्षेपित करके प्राप्त किए जाते हैं जिनसे असममित परमाणु जुड़ा होता है। इस मामले में, असममित परमाणु को आमतौर पर छोड़ दिया जाता है, केवल प्रतिच्छेदी रेखाओं और स्थानापन्न प्रतीकों को बरकरार रखा जाता है। प्रतिस्थापनों की स्थानिक व्यवस्था को याद रखने के लिए, एक टूटी हुई ऊर्ध्वाधर रेखा को अक्सर प्रक्षेपण सूत्रों में संरक्षित किया जाता है (ऊपरी और निचले प्रतिस्थापनों को ड्राइंग के विमान से परे हटा दिया जाता है), लेकिन ऐसा अक्सर नहीं किया जाता है। पिछले चित्र में बायाँ मॉडल:

यहां प्रक्षेपण सूत्रों के कुछ उदाहरण दिए गए हैं:
(+)-अलैनिन(-)2-ब्यूटेनॉल(+)-ग्लिसराल्डिहाइड
पदार्थों के नाम उनके घूर्णन चिन्ह दर्शाते हैं। इसका मतलब है, उदाहरण के लिए, ब्यूटेनॉल-2 का बायां हाथ का एंटीपोड है स्थानिक विन्यास, उपरोक्त सूत्र द्वारा सटीक रूप से व्यक्त किया गया है, और इसकी दर्पण छवि डेक्सट्रोटोटेट्री ब्यूटेनॉल -2 से मेल खाती है। कॉन्फ़िगरेशन परिभाषाऑप्टिकल एंटीपोड प्रयोगात्मक रूप से किया जाता है।
सिद्धांत रूप में, प्रत्येक ऑप्टिकल एंटीपोड को बारह (!) विभिन्न प्रक्षेपण सूत्रों द्वारा चित्रित किया जा सकता है - यह इस पर निर्भर करता है कि प्रक्षेपण का निर्माण करते समय मॉडल कैसे स्थित है, हम इसे किस तरफ से देखते हैं। प्रक्षेपण सूत्रों को मानकीकृत करने के लिए, उन्हें लिखने के लिए कुछ नियम पेश किए गए हैं। इस प्रकार, मुख्य कार्य, यदि यह श्रृंखला के अंत में है, आमतौर पर शीर्ष पर रखा जाता है, मुख्य श्रृंखला को लंबवत रूप से दर्शाया जाता है।
"गैर-मानक" लिखित प्रक्षेपण सूत्रों की तुलना करने के लिए, आपको प्रक्षेपण सूत्रों को बदलने के लिए निम्नलिखित नियमों को जानना होगा। "गैर-मानक" लिखित प्रक्षेपण सूत्रों की तुलना करने के लिए, आपको प्रक्षेपण सूत्रों को बदलने के लिए निम्नलिखित नियमों को जानना होगा।


1. सूत्रों को उनके स्टीरियोकेमिकल अर्थ को बदले बिना ड्राइंग प्लेन में 180° घुमाया जा सकता है:

2. एक असममित परमाणु पर प्रतिस्थापनों की दो (या कोई भी सम संख्या) पुनर्व्यवस्था सूत्र के त्रिविम रासायनिक अर्थ को नहीं बदलती है:

3. असममित केंद्र पर प्रतिस्थापकों का एक (या कोई विषम संख्या) क्रमपरिवर्तन ऑप्टिकल एंटीपोड के सूत्र की ओर ले जाता है:

4. ड्राइंग प्लेन में 90° का घुमाव सूत्र को एंटीपोडियल में बदल देता है, जब तक कि उसी समय ड्राइंग प्लेन के सापेक्ष प्रतिस्थापनों के स्थान की स्थिति नहीं बदल जाती, यानी। इस बात पर विचार न करें कि अब पार्श्व प्रतिस्थापन ड्राइंग विमान के पीछे स्थित हैं, और ऊपरी और निचले वाले इसके सामने हैं। यदि आप बिंदीदार रेखा वाले सूत्र का उपयोग करते हैं, तो बिंदीदार रेखा का बदला हुआ अभिविन्यास आपको सीधे इसकी याद दिलाएगा:
5. क्रमपरिवर्तन के बजाय, किन्हीं तीन प्रतिस्थापनों को दक्षिणावर्त या वामावर्त घुमाकर प्रक्षेपण सूत्रों को रूपांतरित किया जा सकता है; चौथा स्थानापन्न अपनी स्थिति नहीं बदलता है (यह ऑपरेशन दो क्रमपरिवर्तन के बराबर है):

6. प्रक्षेपण सूत्र ड्राइंग तल से प्राप्त नहीं किए जा सकते।
रेसमेट्स।
यदि किसी पदार्थ के सूत्र में एक असममित परमाणु होता है, तो इसका मतलब यह नहीं है कि ऐसे पदार्थ में ऑप्टिकल गतिविधि होगी। यदि एक सामान्य प्रतिक्रिया के दौरान एक असममित केंद्र उत्पन्न होता है (सीएच 2 समूह में प्रतिस्थापन, दोहरे बंधन पर जोड़, आदि), तो दोनों एंटीपोडियन कॉन्फ़िगरेशन बनाने की संभावना समान है। इसलिए, प्रत्येक व्यक्तिगत अणु की विषमता के बावजूद, परिणामी पदार्थ वैकल्पिक रूप से निष्क्रिय हो जाता है। इस प्रकार के वैकल्पिक रूप से निष्क्रिय संशोधन, जिसमें दोनों एंटीपोड समान मात्रा में होते हैं, कहलाते हैं रेसमेट्स
अन्य प्रकार के वैकल्पिक रूप से सक्रिय पदार्थ।
यह खंड कार्बनिक यौगिकों के कुछ अन्य वर्गों को सूचीबद्ध करता है जो ऑप्टिकल गतिविधि भी प्रदर्शित करते हैं (यानी, ऑप्टिकल एंटीपोड के जोड़े के रूप में विद्यमान)।

कार्बनिक यौगिकों के अणुओं में चिरल केंद्रों के निर्माण पर कार्बन परमाणु का एकाधिकार नहीं है। चिरैलिटी का केंद्र चतुर्धातुक अमोनियम लवण और तृतीयक अमाइन ऑक्साइड में सिलिकॉन, टिन और टेट्राकोवैलेंट नाइट्रोजन परमाणु भी हो सकते हैं:
इन यौगिकों में, असममिति के केंद्र में असममित कार्बन परमाणु की तरह टेट्राहेड्रल विन्यास होता है। हालाँकि, चिरल केंद्र की एक अलग स्थानिक संरचना वाले यौगिक भी हैं।

पिरामिड विन्यास त्रिसंयोजक नाइट्रोजन, फास्फोरस, आर्सेनिक, सुरमा और सल्फर के परमाणुओं द्वारा निर्मित चिरल केंद्र है। सिद्धांत रूप में, विषमता के केंद्र को टेट्राहेड्रल माना जा सकता है यदि हेटरोएटोम की अकेली इलेक्ट्रॉन जोड़ी को चौथे प्रतिस्थापन के रूप में लिया जाता है:
ऑप्टिकल गतिविधि भी हो सकती है बिना चिरल केंद्र, समग्र रूप से संपूर्ण अणु की संरचना की चिरलिटी के कारण ( आणविक चिरायता या आणविक विषमता ). सबसे विशिष्ट उदाहरण उपस्थिति हैं चिरल अक्ष या चिरल विमान .

उदाहरण के लिए, चिरल अक्ष विभिन्न प्रतिस्थापन वाले एलीन्स में प्रकट होता है एसपी 2-हाइब्रिड कार्बन परमाणु. यह देखना आसान है कि नीचे दिए गए यौगिक असंगत दर्पण छवियां हैं, और इसलिए ऑप्टिकल एंटीपोड हैं:

चिरल अक्ष वाले यौगिकों का एक अन्य वर्ग ऑप्टिकली सक्रिय बाइफिनाइल है, जो है ऑर्थो-स्थितियों में भारी पदार्थ होते हैं जो बेंजीन रिंगों को जोड़ने वाले सी-सी बांड के चारों ओर मुक्त घूर्णन में बाधा डालते हैं:
चिरल विमान इसकी विशेषता यह है कि इसे "ऊपर" और "नीचे", साथ ही "दाएँ" और "बाएँ" पक्षों के बीच प्रतिष्ठित किया जा सकता है। किरल प्लेन वाले यौगिकों का एक उदाहरण ऑप्टिकली सक्रिय है ट्रान्स-साइक्लोएक्टीन और वैकल्पिक रूप से सक्रिय फेरोसीन व्युत्पन्न:
डायस्टेरोमेरिज़्म।
कई असममित परमाणुओं वाले यौगिकों में महत्वपूर्ण विशेषताएं होती हैं जो उन्हें असममिति के एक केंद्र के साथ पहले चर्चा किए गए सरल ऑप्टिकली सक्रिय पदार्थों से अलग करती हैं।
आइए मान लें कि एक निश्चित पदार्थ के अणु में दो असममित परमाणु हैं; आइए उन्हें सशर्त रूप से ए और बी कहें। यह देखना आसान है कि निम्नलिखित संयोजन वाले अणु संभव हैं:
|
((-) |
((-) |
((-) |
((+) |
||
|
अणु 1 |
एफ ए |
अणु 3 |
आ |
बी बी |
|
|
((+) |
((+) |
((+) |
((-) |
||
|
अणु 2 |
आ |
बी बी |
अणु 4 |
आ |
बी बी |
अणु 1 और 2 ऑप्टिकल एंटीपोड की एक जोड़ी हैं; यही बात अणुओं 3 और 4 की जोड़ी पर भी लागू होती है। यदि हम एंटीपोड के विभिन्न जोड़े - 1 और 3, 1 और 4, 2 और 3, 2 और 4 - के अणुओं की एक दूसरे से तुलना करते हैं, तो हम देखेंगे कि सूचीबद्ध जोड़े ऑप्टिकल एंटीपोड नहीं हैं: एक असममित परमाणु का विन्यास समान है, दूसरे का विन्यास समान नहीं है। ये जोड़े हैं डायस्टेरोमर्स , अर्थात। स्थानिक आइसोमर्स, नहीं एक दूसरे के साथ ऑप्टिकल एंटीपोड का गठन।
डायस्टेरेओमर्स न केवल ऑप्टिकल रोटेशन में, बल्कि अन्य सभी भौतिक स्थिरांकों में भी एक-दूसरे से भिन्न होते हैं: उनके अलग-अलग पिघलने और क्वथनांक, अलग-अलग घुलनशीलताएं आदि होते हैं। डायस्टेरेओमर्स के गुणों में अंतर अक्सर संरचनात्मक आइसोमर्स के बीच गुणों के अंतर से कम नहीं होता है। .

इस प्रकार के यौगिक का एक उदाहरण क्लोरोमालिक एसिड है

इसके स्टीरियोइसोमेरिक रूपों में निम्नलिखित प्रक्षेपण सूत्र हैं:
एरिथ्रो-फार्म तीन-फार्म
टाइटल एरिथ्रो- और तिकड़ी- कार्बोहाइड्रेट एरिथ्रोस और थ्रोस के नाम से आते हैं। इन नामों का उपयोग दो असममित परमाणुओं वाले यौगिकों में प्रतिस्थापनों की सापेक्ष स्थिति को इंगित करने के लिए किया जाता है: एरिथ्रो -आइसोमर्सवे वे हैं जिनके लिए दो समान पार्श्व प्रतिस्थापन मानक प्रक्षेपण सूत्र में एक तरफ (दाएं या बाएं) दिखाई देते हैं; तिकड़ी -आइसोमर्सप्रक्षेपण सूत्र के विभिन्न पक्षों पर समान पार्श्व प्रतिस्थापन होते हैं। दो एरिथ्रो-आइसोमर्स ऑप्टिकल एंटीपोड्स की एक जोड़ी हैं; जब वे मिश्रित होते हैं, तो एक रेसमेट बनता है। ऑप्टिकल आइसोमर्स की एक जोड़ी हैं और तीन-रूप; मिश्रित होने पर वे रेसमेट भी बनाते हैं, जो रेसमेट से गुणों में भिन्न होता है एरिथ्रो-प्रपत्र. इस प्रकार, क्लोरोमालिक एसिड के कुल चार वैकल्पिक रूप से सक्रिय आइसोमर्स और दो रेसमेट्स हैं।
असममित केंद्रों की संख्या में और वृद्धि के साथ, स्थानिक आइसोमर्स की संख्या बढ़ जाती है, और प्रत्येक नए असममित केंद्र में आइसोमर्स की संख्या दोगुनी हो जाती है। यह सूत्र 2 n द्वारा निर्धारित किया जाता है, जहां n असममित केंद्रों की संख्या है।
कुछ संरचनाओं में आंशिक समरूपता दिखाई देने के कारण स्टीरियोइसोमर्स की संख्या घट सकती है। एक उदाहरण टार्टरिक एसिड है, जिसमें व्यक्तिगत स्टीरियोइसोमर्स की संख्या तीन तक कम हो जाती है। उनके प्रक्षेपण सूत्र:

फॉर्मूला I, फॉर्मूला Ia के समान है, क्योंकि यह ड्राइंग के तल में 180° घुमाने पर इसमें परिवर्तित हो जाता है और इसलिए, एक नए स्टीरियोआइसोमर का प्रतिनिधित्व नहीं करता है। इसे वैकल्पिक रूप से निष्क्रिय संशोधन कहा जाता है मेसो फॉर्म . मेसो-सभी वैकल्पिक रूप से सक्रिय पदार्थों में कई समान (यानी, समान प्रतिस्थापन से जुड़े) असममित केंद्रों वाले रूप होते हैं। प्रक्षेपण सूत्र मेसो-रूपों को हमेशा इस तथ्य से पहचाना जा सकता है कि उन्हें एक क्षैतिज रेखा द्वारा दो हिस्सों में विभाजित किया जा सकता है, जो कागज पर लिखे जाने पर औपचारिक रूप से समान होते हैं, लेकिन वास्तव में प्रतिबिंबित होते हैं:
सूत्र II और III टार्टरिक एसिड के ऑप्टिकल एंटीपोड को दर्शाते हैं; जब उन्हें मिलाया जाता है, तो एक वैकल्पिक रूप से निष्क्रिय रेसमेट बनता है - अंगूर एसिड।
ऑप्टिकल आइसोमर्स का नामकरण।

ऑप्टिकल एंटीपोड के नामकरण की सबसे सरल, सबसे पुरानी, लेकिन अभी भी उपयोग में आने वाली प्रणाली "कुंजी" के रूप में चुने गए एक निश्चित मानक पदार्थ के प्रक्षेपण सूत्र के साथ तथाकथित एंटीपोड के प्रक्षेपण सूत्र की तुलना पर आधारित है। इसके लिए हांए-हाइड्रॉक्सी एसिड और ए-अमीनो एसिड, कुंजी उनके प्रक्षेपण सूत्र का ऊपरी भाग है (मानक संकेतन में):
एलहाइड्रॉक्सी एसिड (X = OH) डी-हाइड्रॉक्सी एसिड (X = OH)
एलअमीनो एसिड (एक्स = एनएच 2) डी-अमीनो एसिड (एक्स = एनएच 2)
सभी का विन्यासए-हाइड्रॉक्सी एसिड जिनमें मानक लिखित फिशर प्रक्षेपण सूत्र में बाईं ओर एक हाइड्रॉक्सिल समूह होता है, उन्हें चिह्न द्वारा निर्दिष्ट किया जाता है एल; यदि हाइड्रॉक्सिल दाहिनी ओर प्रक्षेपण सूत्र में स्थित है - चिह्न डी

शर्करा के विन्यास को निर्दिष्ट करने की कुंजी ग्लिसराल्डिहाइड है:
एल(-)-ग्लिसराल्डिहाइड डी-(+)-ग्लिसराल्डिहाइड
चीनी अणुओं में पदनाम डी-या एलकॉन्फ़िगरेशन को संदर्भित करता है निचलाअसममित केंद्र.
प्रणाली डी-,एलपदनाम में महत्वपूर्ण कमियां हैं: सबसे पहले, पदनाम डी-या एलकेवल एक असममित परमाणु के विन्यास को इंगित करता है; दूसरे, कुछ यौगिकों के लिए अलग-अलग प्रतीक प्राप्त होते हैं, यह इस बात पर निर्भर करता है कि ग्लिसराल्डिहाइड या हाइड्रॉक्सीएसिड कुंजी को कुंजी के रूप में लिया गया है या नहीं, उदाहरण के लिए:

मुख्य प्रणाली की ये कमियाँ वर्तमान में इसके उपयोग को वैकल्पिक रूप से सक्रिय पदार्थों के तीन वर्गों तक सीमित करती हैं: शर्करा, अमीनो एसिड और हाइड्रॉक्सी एसिड। सामान्य उपयोग के लिए डिज़ाइन किया गया आर,एस-प्रणाली कहन, इंगोल्ड और प्रीलॉग।
ऑप्टिकल एंटीपोड के आर- या एस-कॉन्फ़िगरेशन को निर्धारित करने के लिए, असममित कार्बन परमाणु के चारों ओर प्रतिस्थापन के टेट्राहेड्रोन को इस तरह से व्यवस्थित करना आवश्यक है कि सबसे कम प्रतिस्थापन (आमतौर पर हाइड्रोजन) की दिशा "पर्यवेक्षक से दूर" हो। फिर, यदि वरिष्ठता में सबसे बड़े से औसत तक और फिर सबसे छोटे तक शेष तीन प्रतिस्थापनों के एक चक्र में संक्रमण के दौरान आंदोलन होता है वामावर्त - यहएस -आइसोमर (अक्षर एस लिखते समय हाथ की समान गति से जुड़ा हुआ), यदि दक्षिणावर्त - यह आर- आइसोमर (अक्षर आर लिखते समय हाथ की गति से जुड़ा हुआ)।
एक असममित परमाणु पर प्रतिस्थापनों की वरिष्ठता निर्धारित करने के लिए, परमाणु संख्याओं की गणना के नियमों का उपयोग किया जाता है, जिन पर हम पहले ही ज्यामितीय आइसोमर्स के Z,E नामकरण के संबंध में चर्चा कर चुके हैं।

प्रक्षेपण सूत्र के अनुसार आर, एस-नोटेशन का चयन करने के लिए, समान संख्या में क्रमपरिवर्तन (जो, जैसा कि हम जानते हैं, सूत्र के स्टीरियोकेमिकल अर्थ को नहीं बदलते हैं) द्वारा प्रतिस्थापनों को व्यवस्थित करना आवश्यक है ताकि सबसे छोटा वे (आमतौर पर हाइड्रोजन) प्रक्षेपण सूत्र के निचले भाग में होते हैं। फिर शेष तीन प्रतिस्थापनों की वरिष्ठता, दक्षिणावर्त गिरते हुए, पदनाम आर से मेल खाती है, वामावर्त - पदनाम एस:
5. स्टीरियोइसोमर्स प्राप्त करने की विधियाँ
शुद्ध स्टीरियोइसोमर प्राप्त करना एक महत्वपूर्ण कार्य है, क्योंकि, एक नियम के रूप में, स्टीरियोइसोमेरिक रूपों में से केवल एक ही जैविक रूप से सक्रिय है। इस बीच, सामान्य परिस्थितियों में, एक नियम के रूप में, स्टीरियोइसोमर्स का मिश्रण बनता है - डायस्टेरोमर्स या ऑप्टिकल एंटीपोड। शुद्ध स्टीरियोइसोमेरिक रूप प्राप्त करने के लिए, ये मिश्रण।
3. फिशर प्रक्षेपण सूत्र
आई-प्लेन पर असममित कार्बन परमाणुओं वाले अणुओं को चित्रित करने के लिए, ई. फिशर द्वारा 18ई1 में प्रस्तावित प्रक्षेपणों का अक्सर उपयोग किया जाता है।
आइए ब्रोमोफ्लोरोक्लोरोमेथेन अणु के उदाहरण का उपयोग करके उनके निर्माण के सिद्धांत पर विचार करें। फिस्चोआ प्रक्षेपण के निर्माण के लिए प्रारंभिक बिंदु अणु का स्थानिक मॉडल या उसके पच्चर के आकार का प्रक्षेपण है।
आइए अणु को इस तरह रखें कि केवल ब्रोमोफ्लोरोक्लोरोमेथेन अणु का कार्बन परमाणु चित्र के तल में रहे, जैसा कि चित्र में दिखाया गया है:
आइए हम सभी परमाणुओं को आरेखण तल पर प्रक्षेपित करें (Br और CL नीचे से ऊपर की ओर, क्योंकि वे आरेखण तल के नीचे स्थित हैं, और F और H ऊपर से नीचे की ओर)। परिणामी प्रक्षेपण संरचनात्मक सूत्र से भिन्न हो, इसके लिए हम असममित कार्बन परमाणु को चित्रित नहीं करने पर सहमत हैं। वह गर्भितऊर्ध्वाधर और क्षैतिज रेखाओं के प्रतिच्छेदन पर फिशर प्रक्षेपण में:

जैसा कि उपरोक्त उदाहरण से देखा जा सकता है, फिशर प्रक्षेपण का निर्माण इस तरह से किया गया है कि प्रतिस्थापन के साथ एक असममित परमाणु के बंधन ऊर्ध्वाधर और क्षैतिज (लेकिन झुके हुए नहीं!) रेखाओं द्वारा दर्शाए जाते हैं।
फिशर प्रक्षेपणों का उपयोग करते समय, यह याद रखना महत्वपूर्ण है कि उनमें ऊर्ध्वाधर रेखा हमसे दूर जाने वाले कनेक्शनों को दर्शाती है, और क्षैतिज रेखा हमारी ओर निर्देशित कनेक्शनों को दर्शाती है। . इससे फिशर अनुमानों का उपयोग करने के लिए निम्नलिखित नियम सामने आते हैं:
फिशर अनुमानों के साथ सूचीबद्ध ऑपरेशन निष्पादित नहीं किए जा सकते, क्योंकि वे एक एंटीपोड प्रक्षेपण की ओर ले जाते हैं।
उदाहरण.
ए) जोड़ीवार क्रमपरिवर्तन की एक सम संख्या। आइए ब्रोमोफ्लोरोक्लोरोमेथेन अणु में F और CI, Br और H परमाणुओं की स्थिति की अदला-बदली करें:

बी) तीन प्रतिस्थापनों की परिपत्र पुनर्व्यवस्था। आइए हम हैलोजन परमाणुओं की एक गोलाकार पुनर्व्यवस्था करें। हम हाइड्रोजन परमाणु को अछूता छोड़ देते हैं:

कई कार्बन परमाणुओं वाले अणुओं के लिए फिशर प्रक्षेपण सूत्रों का निर्माण करते समय, अणु को इस तरह रखा जाता है कि कार्बन श्रृंखला लंबवत रूप से व्यवस्थित हो। सबसे ऊपर रखा गया सबसे अधिक ऑक्सीकृतकार्बन परमाणु (एक नियम के रूप में, यह परमाणु कार्बोनिल CH=O या कार्बोक्सिल COOH समूहों का हिस्सा है):

चतुर्थ. आर,एस - स्टीरियोइसोमर्स का नामकरण।
चूँकि एनैन्टीओमर्स के अलग-अलग निरपेक्ष विन्यास होते हैं, इसलिए इस अंतर को उनके नामों में व्यक्त किया जाना चाहिए। के लिए सबसे आम दृष्टिकोण स्टीरियोसोमर्स का नामकरण आर. काह्न, सी. इंगोल्ड और वी. प्रीलॉग (R.S.Cahn, C.Ingold, V.Prelog, Angew.Chem. (1966), B.78, S.413-447, V. द्वारा प्रस्तावित किया गया था। प्रीलॉग, जी.हेल्मेहेन, एंज्यू.केम (1982), बी.94,एस.614-631)। उनका दृष्टिकोण तथाकथित अनुक्रम नियम पर आधारित है, जिसके अनुसार एक असममित परमाणु पर प्रतिस्थापन होता है अलग-अलग वरिष्ठता सौंपी गई है। फिर उस दिशा पर विचार किया जाता है जिसमें पर्यवेक्षक के सापेक्ष अणु के एक निश्चित अभिविन्यास के लिए प्रतिस्थापन की वरिष्ठता घट जाती है। प्राथमिकता कैसे गिरती है (दक्षिणावर्त या वामावर्त) के आधार पर, चिरलिटी के केंद्र की कॉन्फ़िगरेशन को आर या एस के रूप में नामित किया गया है।
1.आर,एस-नामकरण के सिद्धांत
आइए ब्रोमोफ्लोरोक्लोरोमेथेन एनैन्टीओमर्स (12) और (13) के उदाहरण का उपयोग करके पूर्ण विन्यास के नामकरण की प्रक्रिया के मुख्य चरणों पर विचार करें।
पहला चरणएक असममित परमाणु पर प्रतिस्थापनों की पूर्वता का क्रम निर्धारित करना है।
किसी दिए गए तत्व के समस्थानिकों की वरिष्ठता उनकी द्रव्यमान संख्या बढ़ने के साथ बढ़ती है।
इसके अनुसार, हमारे पास ब्रोमोफ्लोरोक्लोरोमेथेन अणुओं में प्रतिस्थापनों की प्राथमिकता का निम्नलिखित क्रम है:
Br>CI>F>H
सबसे वरिष्ठ डिप्टी को अक्षर a से, वरिष्ठता में अगले को अक्षर b से दर्शाया जाएगा वगैरह। (अर्थात, संक्रमण के दौरान a b c d प्राथमिकता कम हो जाती है):

दूसरा चरण. हम अणु को इस तरह से रखते हैं कि सबसे कम प्रतिस्थापन को पर्यवेक्षक से हटा दिया जाता है (इस मामले में यह कार्बन परमाणु द्वारा अस्पष्ट हो जाएगा) और सबसे कम प्रतिस्थापन के साथ कार्बन के बंधन की धुरी के साथ अणु पर विचार करें:

तीसरा चरण. किस दिशा में निर्धारित करें फॉल्सहमारे दृष्टि क्षेत्र में मौजूद प्रतिनिधियों की वरिष्ठता। यदि वरिष्ठता में गिरावट दक्षिणावर्त होती है, तो हम इसे आर (लैटिन "रेक्टस" से दाएं) अक्षर से दर्शाते हैं। यदि वरिष्ठता वामावर्त गिरती है, तो कॉन्फ़िगरेशन को एस अक्षर (लैटिन "भयावह" से - बाएं) द्वारा दर्शाया जाता है।

एक स्मरणीय नियम भी है जिसके अनुसार आर-आइसोमर में प्रतिस्थापनों की वरिष्ठता में कमी उसी दिशा में होती है जिसमें आर अक्षर का शीर्ष लिखा जाता है, और एस-आइसोमर में - उसी दिशा में होता है S अक्षर के शीर्ष पर लिखा है:
अब हम एनैन्टीओमर्स के पूरे नाम लिख सकते हैं, जो स्पष्ट रूप से उनके पूर्ण विन्यास को दर्शाते हैं:
इस बात पर जोर दिया जाना चाहिए कि आर या एस के रूप में स्टेरज़ोइसोमर कॉन्फ़िगरेशन का पदनाम असममित परमाणु पर सभी चार प्रतिस्थापनों की पूर्वता के क्रम पर निर्भर करता है। इस प्रकार, नीचे दिखाए गए अणुओं में, X समूह के सापेक्ष F, CI और Br परमाणुओं की स्थानिक व्यवस्था समान है:

दिए गए उदाहरणों में हम रूपांतरण के बारे में बात नहीं कर सकते पूर्ण विन्यास, चूंकि प्रारंभिक यौगिक और प्रतिक्रिया उत्पाद आइसोमर्स नहीं हैं (ऊपर देखें, पृष्ठ 20)। उसी समय, एक एनैन्टीओमर का दूसरे में परिवर्तन पूर्ण विन्यास का उलटा होता है:

II.1. अनुरूपताएँ (घूर्णी समरूपता)
सबसे सरल कार्बनिक हाइड्रोकार्बन, मीथेन से उसके निकटतम समरूप, ईथेन में संक्रमण, स्थानिक संरचना की समस्याएं पैदा करता है, जिसके समाधान के लिए अनुभाग में चर्चा किए गए मापदंडों को जानना पर्याप्त नहीं है। वास्तव में, बंधन कोण या बंधन लंबाई को बदले बिना, कोई ईथेन अणु के कई ज्यामितीय रूपों की कल्पना कर सकता है, जो उन्हें जोड़ने वाले सी-सी बंधन के चारों ओर कार्बन टेट्राहेड्रा के पारस्परिक घूर्णन में एक दूसरे से भिन्न होते हैं। इस घूर्णन के परिणामस्वरूप, रोटरी आइसोमर्स (कन्फर्मर्स) . विभिन्न कन्फर्मर्स की ऊर्जा समान नहीं होती है, लेकिन विभिन्न रोटरी आइसोमर्स को अलग करने वाली ऊर्जा बाधा अधिकांश कार्बनिक यौगिकों के लिए छोटी होती है। इसलिए, सामान्य परिस्थितियों में, एक नियम के रूप में, अणुओं को एक कड़ाई से परिभाषित संरचना में ठीक करना असंभव है: आमतौर पर कई घूर्णी रूप आसानी से एक दूसरे में परिवर्तित होकर संतुलन में सह-अस्तित्व में होते हैं।
अनुरूपताओं और उनके नामकरण को ग्राफिक रूप से चित्रित करने की विधियाँ इस प्रकार हैं। आइए ईथेन अणु से शुरुआत करें। इसके लिए, कोई दो अनुरूपताओं के अस्तित्व की भविष्यवाणी कर सकता है जो ऊर्जा में अधिकतम भिन्न हैं। उन्हें नीचे इस प्रकार दर्शाया गया है परिप्रेक्ष्य अनुमान (1) ("आरा मिल बकरियाँ"), पार्श्व प्रक्षेपण (2) और न्यूमैन के सूत्र (3).
परिप्रेक्ष्य प्रक्षेपण (1ए, 1बी) में, सी-सी कनेक्शन की दूरी में जाने की कल्पना की जानी चाहिए; बाईं ओर का कार्बन परमाणु पर्यवेक्षक के करीब है, और दाईं ओर का कार्बन परमाणु उससे बहुत दूर है।
पार्श्व प्रक्षेपण (2ए, 2बी) में, चार एच-परमाणु चित्र के तल में स्थित हैं; कार्बन परमाणु वास्तव में इस तल से कुछ हद तक बाहर तक फैले हुए हैं, लेकिन आम तौर पर सरलतापूर्वक यह माना जाता है कि वे चित्र के तल में भी स्थित हैं। पच्चर के मोटे होने से "बोल्ड" पच्चर के आकार के बंधन परमाणु के पर्यवेक्षक की ओर विमान से बाहर निकलने का संकेत देते हैं, जिस ओर गाढ़ापन आ रहा है। धराशायी पच्चर के आकार के कनेक्शन पर्यवेक्षक से दूरी को चिह्नित करते हैं।
न्यूमैन प्रक्षेपण (3ए, 3बी) में, अणु को सी-सी बांड के साथ माना जाता है (सूत्र 1ए, बी में तीर द्वारा इंगित दिशा में)। वृत्त के केंद्र से 120° के कोण पर विसरित होने वाली तीन रेखाएँ प्रेक्षक के निकटतम कार्बन परमाणु के बंधन को दर्शाती हैं; वृत्त के पीछे से निकलने वाली रेखाएँ दूर स्थित कार्बन परमाणु के बंधन हैं।
बायीं ओर दिखाई गई रचना कहलाती है अस्पष्ट : यह नाम हमें याद दिलाता है कि दोनों CH3 समूहों के हाइड्रोजन परमाणु एक दूसरे के विपरीत हैं। ग्रहण की संरचना ने आंतरिक ऊर्जा में वृद्धि की है और इसलिए प्रतिकूल है। दाहिनी ओर दिखाई गई रचना कहलाती है संकोची , जिसका अर्थ है कि इस स्थिति में सी-सी बांड के चारों ओर मुक्त घुमाव "अवरुद्ध" है, अर्थात। अणु मुख्य रूप से इस संरचना में मौजूद होता है।
किसी अणु को किसी विशेष बंधन के चारों ओर पूर्ण रूप से घुमाने के लिए आवश्यक न्यूनतम ऊर्जा कहलाती है घूर्णन बाधा इस कनेक्शन के लिए. इथेन जैसे अणु में घूर्णन अवरोध को परिवर्तन के फलन के रूप में अणु की स्थितिज ऊर्जा में परिवर्तन के रूप में व्यक्त किया जा सकता है। डायहेड्रल (मरोड़) कोण सिस्टम. डायहेड्रल कोण (ताउ को दर्शाया गया) को नीचे दिए गए चित्र में दर्शाया गया है:

इथेन में सी-सी बांड के चारों ओर घूमने की ऊर्जा प्रोफ़ाइल निम्नलिखित चित्र में दिखाई गई है। "बैक" कार्बन परमाणु के घूर्णन को दिखाए गए दो हाइड्रोजन परमाणुओं के बीच डायहेड्रल कोण में परिवर्तन द्वारा दर्शाया गया है। सरलता के लिए, शेष हाइड्रोजन परमाणुओं को छोड़ दिया गया है। ईथेन के दो रूपों को अलग करने वाला घूर्णन अवरोध केवल 3 kcal/mol (12.6 kJ/mol) है। संभावित ऊर्जा वक्र की न्यूनतम सीमा बाधित अनुरूपताओं के अनुरूप होती है, और अधिकतम सीमा अवरुद्ध अनुरूपताओं के अनुरूप होती है। चूँकि कमरे के तापमान पर कुछ आणविक टकरावों की ऊर्जा 20 kcal/mol (लगभग 80 kJ/mol) तक पहुँच सकती है, 12.6 kJ/mol का यह अवरोध आसानी से दूर हो जाता है और ईथेन में घूर्णन को मुक्त माना जाता है।

हम इस बात पर जोर देते हैं कि संभावित ऊर्जा वक्र पर प्रत्येक बिंदु एक विशिष्ट संरचना से मेल खाता है। मिनिमा के अनुरूप बिंदु, गठनात्मक आइसोमर्स के अनुरूप होते हैं, अर्थात सभी संभावित अनुरूपताओं के मिश्रण में प्रमुख घटक .
जैसे-जैसे अणु अधिक जटिल होता जाता है, ऊर्जा में स्पष्ट रूप से भिन्न संभावित अनुरूपताओं की संख्या बढ़ जाती है। इसके लिए हां एन-ब्यूटेन को पहले से ही छह अनुरूपताओं में दर्शाया जा सकता है, जो सीएच 3 समूहों की सापेक्ष व्यवस्था में भिन्न है, यानी। केंद्रीय कनेक्शन सी-सी के चारों ओर घूमना। नीचे, एन-ब्यूटेन की संरचना को न्यूमैन अनुमानों के रूप में दर्शाया गया है। बाईं ओर दिखाई गई अनुरूपताएं (छायांकित) ऊर्जावान रूप से प्रतिकूल हैं; केवल बाधित लोगों को ही व्यावहारिक रूप से महसूस किया जाता है।

ब्यूटेन की विभिन्न ग्रहणशील और बाधित रचनाएँ ऊर्जा में समान नहीं हैं। केंद्रीय सी-सी बांड के चारों ओर घूमने के दौरान बनने वाली सभी संरचनाओं की संबंधित ऊर्जाएं नीचे प्रस्तुत की गई हैं:



जैसे-जैसे एक अणु अधिक जटिल होता जाता है, संभावित अनुरूपताओं की संख्या बढ़ती जाती है।
तो, अनुरूपण एक अणु के विभिन्न गैर-समान स्थानिक रूप हैं जिनका एक निश्चित विन्यास होता है। कन्फर्मर्स स्टीरियोइसोमेरिक संरचनाएं हैं जो मोबाइल संतुलन में हैं और सरल बांडों के चारों ओर घूमकर अंतर-रूपांतरण करने में सक्षम हैं।
कभी-कभी ऐसे परिवर्तनों में बाधा इतनी अधिक हो जाती है कि स्टीरियोआइसोमेरिक रूपों को अलग किया जा सके (उदाहरण: वैकल्पिक रूप से सक्रिय बाइफिनाइल;)। ऐसे मामलों में, वे अब अनुरूपकर्ताओं के बारे में बात नहीं करते हैं, बल्कि वास्तव में मौजूदा लोगों के बारे में बात करते हैं स्टीरियोआइसोमर .
II.2. ज्यामितीय समरूपता
दोहरे बंधन की कठोरता (इसके चारों ओर घूमने की अनुपस्थिति) का एक महत्वपूर्ण परिणाम अस्तित्व है ज्यामितीय आइसोमर्स . उनमें से सबसे आम हैं सीआईएस-ट्रांस आइसोमर्स एथिलीन श्रृंखला के यौगिक जिनमें असंतृप्त परमाणुओं पर असमान पदार्थ होते हैं। सबसे सरल उदाहरण ब्यूटेन-2 के आइसोमर्स हैं।

ज्यामितीय आइसोमर्स की रासायनिक संरचना (रासायनिक बंधों का समान क्रम) समान होती है, परमाणुओं की स्थानिक व्यवस्था में भिन्नता होती है। विन्यास . यह अंतर भौतिक (साथ ही रासायनिक) गुणों में अंतर पैदा करता है। अनुरूपकों के विपरीत, ज्यामितीय आइसोमर्स को शुद्ध रूप में अलग किया जा सकता है और व्यक्तिगत, स्थिर पदार्थों के रूप में मौजूद हो सकते हैं। उनके पारस्परिक परिवर्तन के लिए आमतौर पर 125-170 kJ/mol (30-40 kcal/mol) के क्रम की ऊर्जा की आवश्यकता होती है। यह ऊर्जा तापन या विकिरण द्वारा प्रदान की जा सकती है।
सरलतम मामलों में, ज्यामितीय आइसोमर्स का नामकरण कोई कठिनाई पेश नहीं करता है: सीआईएस- रूप ज्यामितीय आइसोमर्स हैं जिनमें समान पदार्थ पाई बांड विमान के एक ही तरफ स्थित होते हैं, ट्रान्स- पाई बांड तल के विभिन्न पक्षों पर आइसोमर्स के समान प्रतिस्थापन होते हैं। अधिक जटिल मामलों में इसका उपयोग किया जाता है जेड,ई-नामकरण . इसका मुख्य सिद्धांत: कॉन्फ़िगरेशन को इंगित करना इंगित करना है सीआईएस-(Z, जर्मन ज़ुसामेन से - एक साथ) या ट्रान्स-(ई, जर्मन एंटगेजेन से - विपरीत) स्थान वरिष्ठ प्रतिनिधि दोहरे बंधन के साथ.
Z,E प्रणाली में, उच्च परमाणु क्रमांक वाले प्रतिस्थापकों को वरिष्ठ माना जाता है। यदि असंतृप्त कार्बन से सीधे जुड़े परमाणु समान हैं, तो वे "दूसरी परत" पर चले जाते हैं, यदि आवश्यक हो - "तीसरी परत" आदि पर।
आइए दो उदाहरणों का उपयोग करके Z,E-नामकरण के नियमों के अनुप्रयोग पर विचार करें।

| मैं | द्वितीय |
आइए सूत्र I से शुरू करें, जहां सब कुछ "पहली परत" के परमाणुओं द्वारा हल किया जाता है। उनके परमाणु क्रमांकों को व्यवस्थित करने पर, हम पाते हैं कि प्रत्येक जोड़ी के वरिष्ठ प्रतिस्थापन (सूत्र के ऊपरी भाग में ब्रोमीन और निचले भाग में नाइट्रोजन) हैं ट्रांस-स्थिति, इसलिए स्टीरियोकेमिकल पदनाम ई:
 ई-1-ब्रोमो-1-क्लोरो-2-नाइट्रोएथीन
ई-1-ब्रोमो-1-क्लोरो-2-नाइट्रोएथीन
संरचना II के स्टीरियोकेमिकल पदनाम को निर्धारित करने के लिए, "उच्च परतों" में अंतर देखना आवश्यक है। पहली परत में, समूह सीएच 3, सी 2 एच 5, सी 3 एच 7 भिन्न नहीं हैं। दूसरी परत में, सीएच 3 समूह में तीन (तीन हाइड्रोजन परमाणु) की परमाणु संख्या का योग होता है, जबकि सी 2 एच 5 और सी 3 एच 7 समूहों में से प्रत्येक में 8 परमाणु संख्या होती है। इसका मतलब है कि सीएच 3 समूह पर विचार नहीं किया जाता है - यह अन्य दो से छोटा है। इस प्रकार, वरिष्ठ समूह सी 2 एच 5 और सी 3 एच 7 हैं, यह अंदर है सिस-पद; स्टीरियोकेमिकल पदनाम Z.
 Z-3-मिथाइलहेप्टीन-3
Z-3-मिथाइलहेप्टीन-3
यदि यह निर्धारित करना आवश्यक हो कि कौन सा समूह पुराना है - सी 2 एच 5 या सी 3 एच 7, तो किसी को "तीसरी परत" के परमाणुओं पर जाना होगा; दोनों समूहों के लिए इस परत में परमाणु संख्याओं का योग बराबर होगा क्रमशः 3 और 8 तक, अर्थात्। C3H7, C2H5 से पुराना है। प्राथमिकता निर्धारित करने के अधिक जटिल मामलों में, अतिरिक्त शर्तों को ध्यान में रखा जाना चाहिए, जैसे: दोहरे बंधन से जुड़े परमाणु को दो बार गिना जाता है, ट्रिपल बंधन से जुड़े परमाणु को तीन बार गिना जाता है; आइसोटोप में से, भारी आइसोटोप पुराना है (ड्यूटेरियम हाइड्रोजन से पुराना है) और कुछ अन्य।
ध्यान दें कि अंकन Z नहीं पर्यायवाची हैं सीआईएस-पदनाम, पदनाम ई की तरह, हमेशा स्थान के अनुरूप नहीं होते हैं ट्रान्स-, उदाहरण के लिए:

सीआईएस- 1,2-डाइक्लोरोप्रोपीन-1 सीआईएस- 1,2-डाइक्लोरो-1-ब्रोमोप्रोपीन-1
Z-1,2-डाइक्लोरोप्रोपीन-1 E-1,2-डाइक्लोरो-1-ब्रोमोप्रोपीन-1
नियंत्रण कार्य
1. बॉम्बिकोल - रेशमकीट का एक फेरोमोन (यौन आकर्षणकर्ता) - E-10-Z-12-hexadecadienol-1 है। इसका संरचनात्मक सूत्र बनाइये।
2. Z,E नामकरण का उपयोग करते हुए निम्नलिखित यौगिकों के नाम बताएं:

द्वितीय.3. ऑप्टिकल आइसोमेरिज्म (एनेंटिओमेरिज्म)
कार्बनिक यौगिकों में ऐसे पदार्थ हैं जो प्रकाश के ध्रुवीकरण के तल को घुमा सकते हैं। इस घटना को ऑप्टिकल गतिविधि कहा जाता है, और संबंधित पदार्थ हैं दृष्टिगत रूप से सक्रिय . प्रकाशिक रूप से सक्रिय पदार्थ जोड़े में होते हैं ऑप्टिकल एंटीपोड - आइसोमर्स, जिनके भौतिक और रासायनिक गुण सामान्य परिस्थितियों में समान होते हैं, एक चीज के अपवाद के साथ - ध्रुवीकरण के विमान के घूर्णन का संकेत। (यदि ऑप्टिकल एंटीपोड में से एक में, उदाहरण के लिए, एक विशिष्ट रोटेशन [नोट 1] +20 ओ है, तो दूसरे में -20 ओ का एक विशिष्ट रोटेशन है)।
द्वितीय.4. प्रक्षेपण सूत्र
एक समतल पर एक असममित परमाणु को पारंपरिक रूप से चित्रित करने के लिए, इसका उपयोग करें ई. फिशर के प्रक्षेपण सूत्र . वे उन परमाणुओं को एक तल पर प्रक्षेपित करके प्राप्त किए जाते हैं जिनसे असममित परमाणु जुड़ा होता है। इस मामले में, असममित परमाणु को आमतौर पर छोड़ दिया जाता है, केवल प्रतिच्छेदी रेखाओं और स्थानापन्न प्रतीकों को बरकरार रखा जाता है। प्रतिस्थापनों की स्थानिक व्यवस्था को याद रखने के लिए, एक टूटी हुई ऊर्ध्वाधर रेखा को अक्सर प्रक्षेपण सूत्रों में संरक्षित किया जाता है (ऊपरी और निचले प्रतिस्थापनों को ड्राइंग के विमान से परे हटा दिया जाता है), लेकिन ऐसा अक्सर नहीं किया जाता है। पिछले चित्र में बाएँ मॉडल के अनुरूप प्रक्षेपण सूत्र लिखने के विभिन्न तरीके नीचे दिए गए हैं:

यहां प्रक्षेपण सूत्रों के कुछ उदाहरण दिए गए हैं:

(+)-अलैनिन (-)-ब्यूटेनॉल (+)-ग्लिसराल्डिहाइड
पदार्थों के नाम उनके घूर्णन संकेतों को दर्शाते हैं: इसका मतलब है, उदाहरण के लिए, ब्यूटेनॉल-2 के बाएं हाथ के एंटीपोड में स्थानिक विन्यास , उपरोक्त सूत्र द्वारा सटीक रूप से व्यक्त किया गया है, और इसकी दर्पण छवि डेक्सट्रोटोटेट्री ब्यूटेनॉल -2 से मेल खाती है। कॉन्फ़िगरेशन परिभाषा ऑप्टिकल एंटीपोड प्रयोगात्मक रूप से किया जाता है [नोट 3]।
सिद्धांत रूप में, प्रत्येक ऑप्टिकल एंटीपोड को बारह (!) अलग-अलग प्रक्षेपण सूत्रों द्वारा चित्रित किया जा सकता है - यह इस पर निर्भर करता है कि प्रक्षेपण के दौरान मॉडल कैसे स्थित है और हम इसे किस तरफ से देखते हैं। प्रक्षेपण सूत्रों को मानकीकृत करने के लिए, उन्हें लिखने के लिए कुछ नियम पेश किए गए हैं। इस प्रकार, मुख्य कार्य, यदि यह श्रृंखला के अंत में है, आमतौर पर शीर्ष पर रखा जाता है, मुख्य श्रृंखला को लंबवत रूप से दर्शाया जाता है।
"गैर-मानक" लिखित प्रक्षेपण सूत्रों की तुलना करने के लिए, आपको प्रक्षेपण सूत्रों को बदलने के लिए निम्नलिखित नियमों को जानना होगा।
1. सूत्रों को उनके स्टीरियोकेमिकल अर्थ को बदले बिना ड्राइंग प्लेन में 180° घुमाया जा सकता है:

2. एक असममित परमाणु पर प्रतिस्थापनों की दो (या कोई भी सम संख्या) पुनर्व्यवस्था सूत्र के त्रिविम रासायनिक अर्थ को नहीं बदलती है:

3. असममित केंद्र पर प्रतिस्थापकों का एक (या कोई विषम संख्या) क्रमपरिवर्तन ऑप्टिकल एंटीपोड के सूत्र की ओर ले जाता है:

4. ड्राइंग प्लेन में 90° का घुमाव सूत्र को एंटीपोडियल में बदल देता है, जब तक कि उसी समय ड्राइंग प्लेन के सापेक्ष प्रतिस्थापनों के स्थान की स्थिति नहीं बदल जाती, यानी। इस बात पर विचार न करें कि अब पार्श्व प्रतिस्थापन ड्राइंग विमान के पीछे स्थित हैं, और ऊपरी और निचले वाले इसके सामने हैं। यदि आप बिंदीदार रेखा वाले सूत्र का उपयोग करते हैं, तो बिंदीदार रेखा का बदला हुआ अभिविन्यास आपको सीधे इसकी याद दिलाएगा:

5. क्रमपरिवर्तन के बजाय, किन्हीं तीन प्रतिस्थापनों को दक्षिणावर्त या वामावर्त घुमाकर प्रक्षेपण सूत्रों को रूपांतरित किया जा सकता है; चौथा स्थानापन्न अपनी स्थिति नहीं बदलता है (यह ऑपरेशन दो क्रमपरिवर्तन के बराबर है):

6. प्रक्षेपण सूत्र ड्राइंग के तल से प्राप्त नहीं किए जा सकते (अर्थात, उदाहरण के लिए, आप उन्हें कागज के पीछे से "प्रकाश में" जांच नहीं सकते - इस मामले में, सूत्र का स्टीरियोकेमिकल अर्थ बदल जाएगा)।
द्वितीय.5. रेसमेट्स
यदि किसी पदार्थ के सूत्र में एक असममित परमाणु होता है, तो इसका मतलब यह नहीं है कि ऐसे पदार्थ में ऑप्टिकल गतिविधि होगी। यदि एक सामान्य प्रतिक्रिया के दौरान एक असममित केंद्र उत्पन्न होता है (सीएच 2 समूह में प्रतिस्थापन, दोहरे बंधन पर जोड़, आदि), तो दोनों एंटीपोडियन कॉन्फ़िगरेशन बनाने की संभावना समान है। इसलिए, प्रत्येक व्यक्तिगत अणु की विषमता के बावजूद, परिणामी पदार्थ वैकल्पिक रूप से निष्क्रिय हो जाता है। इस प्रकार के वैकल्पिक रूप से निष्क्रिय संशोधन, जिसमें दोनों एंटीपोड समान मात्रा में होते हैं, कहलाते हैं रेसमेट्स [नोट 4] .
द्वितीय.6. डायस्टेरोमेरिज़्म
कई असममित परमाणुओं वाले यौगिकों में महत्वपूर्ण विशेषताएं होती हैं जो उन्हें असममिति के एक केंद्र के साथ पहले चर्चा किए गए सरल ऑप्टिकली सक्रिय पदार्थों से अलग करती हैं।
आइए मान लें कि एक निश्चित पदार्थ के अणु में दो असममित परमाणु हैं; आइए उन्हें सशर्त रूप से ए और बी कहें। यह देखना आसान है कि निम्नलिखित संयोजन वाले अणु संभव हैं:
अणु 1 और 2 ऑप्टिकल एंटीपोड की एक जोड़ी हैं; यही बात अणुओं 3 और 4 की जोड़ी पर भी लागू होती है। यदि हम एंटीपोड के विभिन्न जोड़े - 1 और 3, 1 और 4, 2 और 3, 2 और 4 - के अणुओं की एक दूसरे से तुलना करते हैं, तो हम देखेंगे कि सूचीबद्ध जोड़े ऑप्टिकल एंटीपोड नहीं हैं: एक असममित परमाणु का विन्यास समान है, दूसरे का विन्यास समान नहीं है। ये सभी कपल हैं डायस्टेरोमर्स , अर्थात। स्थानिक आइसोमर्स, नहीं एक दूसरे के साथ ऑप्टिकल एंटीपोड का गठन।
डायस्टेरेओमर्स न केवल ऑप्टिकल रोटेशन में, बल्कि अन्य सभी भौतिक स्थिरांकों में भी एक-दूसरे से भिन्न होते हैं: उनके अलग-अलग पिघलने और क्वथनांक, अलग-अलग घुलनशीलताएं आदि होते हैं। डायस्टेरेओमर्स के गुणों में अंतर अक्सर संरचनात्मक आइसोमर्स के बीच गुणों के अंतर से कम नहीं होता है। .
इस प्रकार के यौगिक का एक उदाहरण क्लोरोमालिक एसिड है

इसके स्टीरियोइसोमेरिक रूपों में निम्नलिखित प्रक्षेपण सूत्र हैं:

एरिथ्रो-फार्म तीन-फार्म
टाइटल एरिथ्रो- और तिकड़ी- कार्बोहाइड्रेट एरिथ्रोस और थ्रोस के नाम से आते हैं। इन नामों का उपयोग दो असममित परमाणुओं वाले यौगिकों में प्रतिस्थापनों की सापेक्ष स्थिति को इंगित करने के लिए किया जाता है: एरिथ्रो -आइसोमर्सवे वे हैं जिनके लिए दो समान पार्श्व प्रतिस्थापन मानक प्रक्षेपण सूत्र में एक तरफ (दाएं या बाएं) दिखाई देते हैं; तिकड़ी -आइसोमर्सप्रक्षेपण सूत्र के विभिन्न पक्षों पर समान पार्श्व प्रतिस्थापन हैं [नोट 5]।
दो एरिथ्रो-आइसोमर्स ऑप्टिकल एंटीपोड्स की एक जोड़ी हैं; जब वे मिश्रित होते हैं, तो एक रेसमेट बनता है। ऑप्टिकल आइसोमर्स की एक जोड़ी हैं और तीन-रूप; मिश्रित होने पर वे रेसमेट भी बनाते हैं, जो रेसमेट से गुणों में भिन्न होता है एरिथ्रो-प्रपत्र. इस प्रकार, क्लोरोमालिक एसिड के कुल चार वैकल्पिक रूप से सक्रिय आइसोमर्स और दो रेसमेट्स हैं।
असममित केंद्रों की संख्या में और वृद्धि के साथ, स्थानिक आइसोमर्स की संख्या बढ़ जाती है, और प्रत्येक नए असममित केंद्र में आइसोमर्स की संख्या दोगुनी हो जाती है। यह सूत्र 2 n द्वारा निर्धारित किया जाता है, जहां n असममित केंद्रों की संख्या है।
कुछ संरचनाओं में आंशिक समरूपता दिखाई देने के कारण स्टीरियोइसोमर्स की संख्या घट सकती है। एक उदाहरण टार्टरिक एसिड है, जिसमें व्यक्तिगत स्टीरियोइसोमर्स की संख्या तीन तक कम हो जाती है। उनके प्रक्षेपण सूत्र:

फॉर्मूला I, फॉर्मूला Ia के समान है: ड्राइंग के तल में 180° घुमाने पर यह इसमें बदल जाता है और इसलिए, एक नए स्टीरियोइसोमर का प्रतिनिधित्व नहीं करता है। यह एक वैकल्पिक रूप से निष्क्रिय संशोधन है - मेसो फॉर्म . रेसमेट के विपरीत, जिसे ऑप्टिकल में विभाजित किया जा सकता है प्रतिलोभ, मेसो-रूप मौलिक रूप से अविनाशी है: इसके प्रत्येक अणु में एक विन्यास का एक असममित केंद्र होता है, और दूसरा - विपरीत। परिणामस्वरूप, दोनों असममित केंद्रों के घूर्णन का इंट्रामोल्युलर मुआवजा होता है।
मेसो-सभी वैकल्पिक रूप से सक्रिय पदार्थों में कई समान (अर्थात्, समान प्रतिस्थापनों से जुड़े) असममित केंद्रों वाले रूप होते हैं [नोट 6]। प्रक्षेपण सूत्र मेसो-रूपों को हमेशा इस तथ्य से पहचाना जा सकता है कि उन्हें हमेशा एक क्षैतिज रेखा द्वारा दो हिस्सों में विभाजित किया जा सकता है, जो कागज पर लिखे जाने पर औपचारिक रूप से समान होते हैं, लेकिन वास्तव में प्रतिबिंबित होते हैं:

सूत्र II और III टार्टरिक एसिड के ऑप्टिकल एंटीपोड को दर्शाते हैं; जब उन्हें मिलाया जाता है, तो एक वैकल्पिक रूप से निष्क्रिय रेसमेट बनता है - अंगूर एसिड।
द्वितीय.7. ऑप्टिकल आइसोमर्स का नामकरण
ऑप्टिकल एंटीपोड के नामकरण की सबसे सरल, सबसे पुरानी, लेकिन अभी भी उपयोग में आने वाली प्रणाली "कुंजी" के रूप में चुने गए एक निश्चित मानक पदार्थ के प्रक्षेपण सूत्र के साथ तथाकथित एंटीपोड के प्रक्षेपण सूत्र की तुलना पर आधारित है। इस प्रकार, अल्फा हाइड्रॉक्सी एसिड और अल्फा अमीनो एसिड के लिए, कुंजी उनके प्रक्षेपण सूत्र का ऊपरी भाग है (मानक नोटेशन में):

एलहाइड्रॉक्सी एसिड (X = OH) डी-हाइड्रॉक्सी एसिड (X = OH)
एल-अमीनो एसिड (एक्स = एनएच 2) डी-अमीनो एसिड (एक्स = एनएच 2)
मानक लिखित फिशर प्रक्षेपण सूत्र में बाईं ओर हाइड्रॉक्सिल समूह वाले सभी अल्फा-हाइड्रॉक्सी एसिड का विन्यास संकेत द्वारा दर्शाया गया है एल; यदि हाइड्रॉक्सिल दाहिनी ओर प्रक्षेपण सूत्र में स्थित है - चिह्न डी[नोट 7] .
शर्करा के विन्यास को निर्दिष्ट करने की कुंजी ग्लिसराल्डिहाइड है:

एल-(-)-ग्लिसराल्डिहाइड डी-(+)-ग्लिसराल्डिहाइड
चीनी अणुओं में पदनाम डी-या एलकॉन्फ़िगरेशन को संदर्भित करता है निचलाअसममित केंद्र.
प्रणाली डी-,एलपदनाम में महत्वपूर्ण कमियां हैं: सबसे पहले, पदनाम डी-या एलकेवल एक असममित परमाणु के विन्यास को इंगित करता है; दूसरे, कुछ यौगिकों के लिए अलग-अलग प्रतीक प्राप्त होते हैं, यह इस बात पर निर्भर करता है कि ग्लिसराल्डिहाइड या हाइड्रॉक्सीएसिड कुंजी को कुंजी के रूप में लिया गया है या नहीं, उदाहरण के लिए:

मुख्य प्रणाली की ये कमियाँ वर्तमान में इसके उपयोग को वैकल्पिक रूप से सक्रिय पदार्थों के तीन वर्गों तक सीमित करती हैं: शर्करा, अमीनो एसिड और हाइड्रॉक्सी एसिड। सामान्य उपयोग के लिए डिज़ाइन किया गया "आर,एस-प्रणाली काह्न, इंगोल्ड और प्रीलॉग [नोट 8]।
ऑप्टिकल एंटीपोड के आर- या एस-कॉन्फ़िगरेशन को निर्धारित करने के लिए, असममित कार्बन परमाणु के चारों ओर प्रतिस्थापन के टेट्राहेड्रोन को इस तरह से व्यवस्थित करना आवश्यक है कि सबसे कम प्रतिस्थापन (आमतौर पर हाइड्रोजन) की दिशा "पर्यवेक्षक से दूर" हो। फिर यदि वरिष्ठता में सबसे बड़े से औसत और फिर सबसे छोटे तक शेष तीन प्रतिस्थापनों के एक चक्र में संक्रमण के दौरान आंदोलन होता है वामावर्त - यह आर -आइसोमर (अक्षर आर लिखते समय हाथ की समान गति से जुड़ा हुआ), यदि दक्षिणावर्त - यह एस- आइसोमर (अक्षर एस लिखते समय हाथ की समान गति से जुड़ा हुआ)।
एक असममित परमाणु पर प्रतिस्थापनों की वरिष्ठता निर्धारित करने के लिए, परमाणु संख्याओं की गणना के नियमों का उपयोग किया जाता है, जिन पर हम पहले ही ज्यामितीय आइसोमर्स के जेड, ई नामकरण के संबंध में विचार कर चुके हैं (देखें)।
प्रक्षेपण सूत्र के अनुसार आर, एस-नोटेशन का चयन करने के लिए, समान संख्या में क्रमपरिवर्तन (जो, जैसा कि हम जानते हैं, सूत्र के स्टीरियोकेमिकल अर्थ को नहीं बदलते हैं) द्वारा प्रतिस्थापनों को व्यवस्थित करना आवश्यक है ताकि सबसे छोटा वे (आमतौर पर हाइड्रोजन) प्रक्षेपण सूत्र के निचले भाग में होते हैं। फिर शेष तीन प्रतिस्थापनों की वरिष्ठता, दक्षिणावर्त गिरते हुए, पदनाम आर से मेल खाती है, वामावर्त - पदनाम एस [नोट 9]:

नियंत्रण कार्य
3. एस्कॉर्बिक एसिड (विटामिन सी) के असममित केंद्र का विन्यास निर्धारित करें (द्वारा) आर, एस-नामकरण और ग्लिसराल्डिहाइड की तुलना में):

4. एल्कलॉइड एफेड्रिन का सूत्र है:

इस कनेक्शन का उपयोग करते हुए एक नाम दें आर, एस- नामपद्धति।
5. सिस्टीन - चयापचय प्रक्रियाओं के नियमन में शामिल एक गैर-आवश्यक अमीनो एसिड है एल-1-अमीनो-2-मर्कैप्टोप्रोपियोनिक एसिड। इसका संरचनात्मक सूत्र बनाइये तथा नाम बताइये आर, एस- नामपद्धति।
6. लेवोमाइसेटिन (ब्रॉड-स्पेक्ट्रम एंटीबायोटिक) है डी(-)-थ्रेओ-1-पैरा-नाइट्रोफेनिल-2-डाइक्लोरोएसिटाइलमिनो-प्रोपेनेडियोल-1,3। फिशर प्रक्षेपण सूत्र के रूप में इसकी संरचना बनाइये।
7. सिनेस्ट्रोल एक गैर-स्टेरायडल संरचना वाली सिंथेटिक एस्ट्रोजन दवा है। इसके त्रिविम रासायनिक विन्यास को दर्शाते हुए इसका नाम बताइए:

द्वितीय.8. चक्रीय यौगिकों की स्टीरियोकैमिस्ट्री
जब कार्बन परमाणुओं की एक श्रृंखला को एक समतल चक्र में बंद किया जाता है, तो कार्बन परमाणुओं के बंधन कोणों को उनके सामान्य टेट्राहेड्रल मान से विचलित होने के लिए मजबूर किया जाता है, और इस विचलन का परिमाण चक्र में परमाणुओं की संख्या पर निर्भर करता है। संयोजकता बंधों का विचलन कोण जितना अधिक होगा, अणु का ऊर्जा भंडार उतना ही अधिक होगा, चक्र उतना ही कम स्थिर होगा। हालाँकि, केवल तीन-सदस्यीय चक्रीय हाइड्रोकार्बन (साइक्लोप्रोपेन) में एक सपाट संरचना होती है; साइक्लोब्यूटेन से शुरू होकर, साइक्लोअल्केन अणुओं में एक गैर-प्लानर संरचना होती है, जो सिस्टम में "तनाव" को कम करती है।
साइक्लोहेक्सेन अणु कई संरचनाओं में मौजूद हो सकता है जिसमें "सामान्य" बंधन कोण बरकरार रहते हैं (सरलता के लिए, केवल कार्बन परमाणु दिखाए जाते हैं):

सबसे ऊर्जावान रूप से अनुकूल रचना रचना I है - तथाकथित रूप "आर्मचेयर". रचना II - "मोड़" - एक मध्यवर्ती स्थिति रखता है: यह कुर्सी संरचना की तुलना में कम अनुकूल है (इसमें अस्पष्ट हाइड्रोजन परमाणुओं की उपस्थिति के कारण), लेकिन संरचना III की तुलना में अधिक अनुकूल है। रचना III - "नहाना" - ऊपर की ओर निर्देशित हाइड्रोजन परमाणुओं के महत्वपूर्ण प्रतिकर्षण के कारण तीनों में से सबसे कम अनुकूल।
कुर्सी संरचना में बारह सी-एच बांडों पर विचार करने से हमें उन्हें दो समूहों में विभाजित करने की अनुमति मिलती है: छह AXIAL कनेक्शन बारी-बारी से ऊपर और नीचे निर्देशित होते हैं, और छह इक्वेटोरियल कनेक्शन पक्षों की ओर निर्देशित हैं। मोनोप्रतिस्थापित साइक्लोहेक्सेन में, प्रतिस्थापी भूमध्यरेखीय या अक्षीय स्थिति में हो सकता है। ये दोनों संरचनाएं आमतौर पर संतुलन में होती हैं और मोड़ संरचना के माध्यम से तेजी से एक दूसरे में परिवर्तित हो जाती हैं:

भूमध्यरेखीय संरचना (ई) आमतौर पर ऊर्जा में कम होती है और इसलिए अक्षीय संरचना (ए) की तुलना में अधिक लाभप्रद होती है।
जब रिंगों में प्रतिस्थापन (साइड चेन) दिखाई देते हैं, तो रिंग की संरचना की समस्या के अलावा, शोधकर्ता को भी समस्याओं का सामना करना पड़ता है स्थानापन्न विन्यास : इस प्रकार, दो समान या भिन्न प्रतिस्थापनों की उपस्थिति के मामले में, सिस-ट्रांस-आइसोमर. ध्यान दें के बारे में बात कर रहे हैं सिस-ट्रांस-प्रतिस्थापकों का विन्यास तभी समझ में आता है जब संतृप्त छोटे और मध्यम रिंगों (सी 8 तक) पर लागू किया जाता है: बड़ी संख्या में इकाइयों वाले रिंगों में, गतिशीलता इतनी महत्वपूर्ण हो जाती है कि इसके बारे में चर्चा होती है सीआईएस-या ट्रांस- प्रतिनिधियों के पद अपना अर्थ खो देते हैं।
इस प्रकार, एक उत्कृष्ट उदाहरण स्टीरियोइसोमेरिक साइक्लोप्रोपेन-1,2-डाइकारबॉक्सिलिक एसिड है। दो स्टीरियोइसोमेरिक एसिड होते हैं: उनमें से एक, एम.पी. वाला। 139 o C, चक्रीय एनहाइड्राइड बनाने में सक्षम है और इसलिए, सिस-आइसोमर. एक और स्टीरियोइसोमेरिक एसिड एम.पी. 175 o C, चक्रीय एनहाइड्राइड नहीं बनाता है; यह ट्रांस-आइसोमर [नोट 10]:

दो स्टीरियोआइसोमेरिक 1,2,2-ट्राइमिथाइलसाइक्लोपेंटेन-1,3-डाइकारबॉक्सिलिक एसिड एक दूसरे के साथ समान संबंध में हैं। उनमें से एक, कैम्फोरिक एसिड, एम.पी. 187 o C, एक एनहाइड्राइड बनाता है और इसलिए, है सिस-आइसोमर. दूसरा है आइसोकैम्फोरिक एसिड, एम.पी. 171 o C, - यह एनहाइड्राइड नहीं बनाता है ट्रांस-आइसोमर:
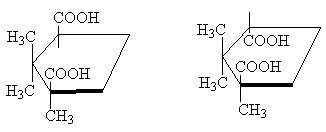
सिस-पार
यद्यपि साइक्लोपेंटेन अणु वास्तव में समतलीय नहीं है, स्पष्टता के लिए इसे समतल रूप में चित्रित करना सुविधाजनक है, जैसा कि ऊपर दिए गए चित्र में है, यह ध्यान में रखते हुए कि सीआईएस-आइसोमर के दो स्थानापन्न होते हैं चक्र के एक तरफ , और में ट्रांस-आइसोमर - चक्र के विपरीत पक्षों पर .
अप्रतिस्थापित साइक्लोहेक्सेन डेरिवेटिव सीआईएस या ट्रांस रूप में भी मौजूद हो सकते हैं:
कार्बनिक यौगिकों के अणुओं में चिरल केंद्रों के निर्माण पर कार्बन परमाणु का एकाधिकार नहीं है। चिरैलिटी का केंद्र चतुर्धातुक अमोनियम लवण और तृतीयक अमाइन ऑक्साइड में सिलिकॉन, टिन और टेट्राकोवैलेंट नाइट्रोजन परमाणु भी हो सकते हैं:

इन यौगिकों में, असममिति के केंद्र में असममित कार्बन परमाणु की तरह टेट्राहेड्रल विन्यास होता है। हालाँकि, चिरल केंद्र की एक अलग स्थानिक संरचना वाले यौगिक भी हैं।
त्रिसंयोजक नाइट्रोजन, फास्फोरस, आर्सेनिक, सुरमा और सल्फर के परमाणुओं द्वारा निर्मित चिरल केंद्रों में एक पिरामिड विन्यास होता है। सिद्धांत रूप में, विषमता के केंद्र को टेट्राहेड्रल माना जा सकता है यदि हेटरोएटोम की अकेली इलेक्ट्रॉन जोड़ी को चौथे प्रतिस्थापन के रूप में लिया जाता है:

ऑप्टिकल गतिविधि भी हो सकती है बिना चिरल केंद्र, समग्र रूप से संपूर्ण अणु की संरचना की चिरलिटी के कारण ( आणविक चिरायता या आणविक विषमता ). सबसे विशिष्ट उदाहरण उपस्थिति हैं चिरल अक्ष या चिरल विमान .
उदाहरण के लिए, चिरल अक्ष विभिन्न प्रतिस्थापन वाले एलीन्स में प्रकट होता है एसपी 2-हाइब्रिड कार्बन परमाणु. यह देखना आसान है कि नीचे दिए गए यौगिक दर्पण छवियां हैं, और इसलिए ऑप्टिकल एंटीपोड हैं:

चिरैलिटी अक्ष को एक तीर द्वारा आंकड़ों में दिखाया गया है।
चिरल अक्ष वाले यौगिकों का एक अन्य वर्ग ऑप्टिकली सक्रिय बाइफिनाइल है, जो है ऑर्थो-स्थितियों में भारी पदार्थ होते हैं जो एरेन रिंगों को जोड़ने वाले सी-सी बांड के चारों ओर मुक्त घूर्णन में बाधा डालते हैं:

चिरल विमान इसकी विशेषता यह है कि इसे "ऊपर" और "नीचे", साथ ही "दाएँ" और "बाएँ" पक्षों के बीच प्रतिष्ठित किया जा सकता है। किरल प्लेन वाले यौगिकों का एक उदाहरण ऑप्टिकली सक्रिय है ट्रान्स-साइक्लोओक्टीन और एक वैकल्पिक रूप से सक्रिय फेरोसीन व्युत्पन्न।
इन सूत्रों का उपयोग आमतौर पर अणुओं के स्थानिक प्रतिनिधित्व के लिए किया जाता है असममित कार्बन परमाणु : यह चतुष्फलकीय है ( एसपी 3-हाइब्रिड) कार्बन परमाणु चार अलग-अलग परमाणुओं या परमाणुओं के समूहों से जुड़ा होता है।
प्रक्षेपण सूत्र को चित्रित करने के लिए, अणु के टेट्राहेड्रल मॉडल को इस प्रकार रखा गया है कि असममित परमाणु ड्राइंग के विमान में है, और असममित कार्बन परमाणु से दो बंधन एक क्षैतिज विमान में स्थित हैं जो ड्राइंग के विमान से पर्यवेक्षक की ओर फैला हुआ है। . अन्य दो कनेक्शन ड्राइंग विमान से परे पर्यवेक्षक से दूर फैले ऊर्ध्वाधर विमान में स्थित होने चाहिए।
फिशर अनुमानों का उपयोग करते समय, असममित कार्बन परमाणु का प्रतीक आमतौर पर छोड़ दिया जाता है:
यह हमेशा ध्यान में रखा जाना चाहिए कि फिशर के सूत्र एक विमान पर प्रक्षेपण हैं और उन्हें स्थानिक मॉडल के रूप में नहीं माना जाना चाहिए।
इसलिए, निम्नलिखित नियमों का पालन किया जाना चाहिए:
एक विशिष्ट स्टीरियोआइसोमर के अनुरूप प्रक्षेपण सूत्र को ड्राइंग के विमान से हटाया नहीं जा सकता है और विमान में 90 ओ और 270 ओ तक घुमाया नहीं जा सकता है;
सूत्र को 180° घुमाया जा सकता है

यदि एक परमाणु समूह की स्थिति नहीं बदलती है, तो अन्य तीन को दक्षिणावर्त या वामावर्त घुमाया जा सकता है:

4.2. ऑप्टिकल गतिविधि* और चिरैलिटी
ऑप्टिकल गतिविधि से तात्पर्य ध्रुवीकृत प्रकाश के तल को घुमाने (एक निश्चित कोण से विचलन) करने की किसी पदार्थ की संपत्ति, क्षमता से है।
ध्रुवीकरण के तल का घूर्णन या तो दक्षिणावर्त (दायाँ घूर्णन) या वामावर्त (बाएँ घूर्णन) होता है।
एक असममित कार्बन परमाणु वाले यौगिक के लिए, दो आइसोमर्स संभव हैं, जो एक वस्तु और उसकी दर्पण छवि के रूप में एक दूसरे से संबंधित हैं, जैसा कि लैक्टिक एसिड के उदाहरण में देखा जा सकता है।


दो आइसोमर्स, जिनमें से प्रत्येक दूसरे की दर्पण छवि है, कहलाते हैं ऑप्टिकल या दर्पण आइसोमर्स .
दर्पण आइसोमर्स की ऐसी जोड़ी को कहा जाता है एनंटीओमर या ऑप्टिकल एंटीपोड .
ध्रुवीकरण के तल के घूर्णन की दिशा को छोड़कर, एनैन्टीओमर्स के भौतिक गुण समान होते हैं: वे ध्रुवीकृत प्रकाश को एक ही कोण पर, लेकिन विपरीत दिशाओं में विक्षेपित करते हैं।
ऐसे यौगिक जो अपनी दर्पण छवि के साथ असंगत होते हैं, कहलाते हैं chiral .
चिरैलिटी (चीर - हाथ से) स्टीरियोकेमिस्ट्री की एक मूल अवधारणा है, जो किसी वस्तु की दर्पण छवि के साथ असंगत होने की संपत्ति को दर्शाती है; अणुओं की ऑप्टिकल गतिविधि के लिए एक शर्त है।
दोनों एनैन्टीओमर्स की समान मात्रा वाले पदार्थों के मिश्रण को कहा जाता है मिश्रण का गुच्छा . ऐसे मिश्रण की ऑप्टिकल गतिविधि 0 है।
स्टीरियोइसोमर्स जो एनैन्टीओमर्स नहीं हैं, कहलाते हैं डायस्टेरोमर्स (विवरण के लिए नीचे अनुभाग 4.4 देखें।)
इस प्रकार, सभी चिरल अणु वैकल्पिक रूप से सक्रिय यौगिकों के अणु हैं।
चिरैलिटी और ऑप्टिकल गतिविधि के बीच एक-से-एक पत्राचार है। चिरल अणुओं की एक विशिष्ट विशेषता एक अक्ष, केंद्र और समरूपता के तल की अनुपस्थिति है, जो हैं समरूपता के तत्व .
समरूपता की धुरी।यदि 2π/n=360 o/n के कोण पर अणु से गुजरने वाली धुरी के चारों ओर घूमने से यह फिर से अपनी मूल स्थिति में आ जाता है, तो ऐसी धुरी कहलाती है nवें क्रम की समरूपता की धुरी С n . यह स्पष्ट है कि n=1 मान के साथ, किसी भी स्थिति में, अक्ष के चारों ओर घूमने से अणु अपनी मूल स्थिति में लौट आता है।
उदाहरण के लिए, पानी के अणु (ए) में दूसरे क्रम का समरूपता अक्ष (एन = 2) है, क्लोरोमेथेन (बी) में तीसरा क्रम है, और बेंजीन (सी) में चक्र के विमान में स्थित छह अक्षों के साथ (एन) =2), एक और अक्ष (n=6) है, जो चक्र के तल के लंबवत है।

समरूपता का तल.यदि किसी अणु (वस्तु) से गुजरने वाला तल उसे दर्पण आइसोमर्स के रूप में एक दूसरे से संबंधित दो भागों में विभाजित करता है, तो इसे कहा जाता है समरूपता का तल . पानी में समरूपता के दो तल होते हैं, और क्लोरोमेथेन में तीन होते हैं।

समरूपता का केंद्र I- यह एक अणु के केंद्र में एक बिंदु है, समान दूरी पर जिससे किसी दिए गए अणु के दो समतुल्य, समतुल्य बिंदु एक ही सीधी रेखा पर स्थित होते हैं।
एक अणु में एक से अधिक सममिति केंद्र नहीं हो सकते।
इस प्रकार, अणुओं में समरूपता तत्वों की उपस्थिति या अनुपस्थिति के दृष्टिकोण से बात करना प्रथागत है दाहिनी ओर और अचिरता . ज्यादातर मामलों में, उनका अर्थ "विषमता" और "समरूपता" की अवधारणाओं से मेल खाता है। हालाँकि, चिरलिटी विषमता की तुलना में बहुत व्यापक अवधारणा है, क्योंकि चिरल अणु में कुछ समरूपता तत्व हो सकते हैं। इसी कारण से, स्टीरियोकेमिस्ट्री में, "असममित" परमाणु शब्द को अक्सर "चिरलिटी का केंद्र" शब्द से बदल दिया जाता है। इसलिए, चिरलिटी को किसी वस्तु की उसकी दर्पण छवि के साथ असंगत होने के गुण के रूप में समझा जाना चाहिए। एक अचिरल अणु में समरूपता का कम से कम एक तत्व होता है (या तो एक केंद्र या समरूपता का एक तल)। अचिरलिटी का एक विशेष मामला है चिरायता: एक संरचनात्मक टुकड़े में एक बार के परिवर्तन के माध्यम से एक अचिरल अणु को एक चिरल में बदलने की क्षमता, संपत्ति। एक नियम के रूप में, यदि कोई हो तो ऐसा ऑपरेशन संभव है प्रोचिरल केंद्र - अर्थात, एक केंद्र जिसमें दो भिन्न और दो समान पदार्थ होते हैं। इन समान प्रतिस्थापनों में से एक को दूसरे के साथ प्रतिस्थापित करना, सभी मौजूदा से अलग, इस केंद्र को एक चिरल में बदल देता है:

विन्यास और संरूपण
स्टीरियोइसोमर्स भिन्न हो सकते हैं विन्यास (कॉन्फ़िगरेशन आइसोमर्स) या रचना (संरचनात्मक आइसोमर्स)।
विन्यास- चिरल केंद्र, डबल बॉन्ड प्लेन या रिंग प्लेन के आसपास परमाणुओं और/या परमाणु समूहों की स्थानिक व्यवस्था और एक निश्चित स्टीरियोइसोमर की विशेषता। यह अवधारणा प्रकृति में काफी हद तक गुणात्मक है और अनिवार्य रूप से किसी दिए गए अणु के चिरल केंद्र के आसपास अंतरिक्ष में परमाणुओं की विशिष्ट व्यवस्था की स्टीरियोकेमिकल विशेषता को दर्शाती है।
यौगिकों के जोड़े जो विन्यासात्मक आइसोमर्स हैं, नीचे दिखाए गए हैं:

रचना*- अणु की एक निश्चित ज्यामिति, सरल बंधों के आसपास परमाणुओं या परमाणु समूहों के आंतरिक घूर्णन के कारण। इस मामले में, अणु का स्टीरियोकेमिकल विन्यास अपरिवर्तित रहता है।
न्यूमैन प्रक्षेपणों का उपयोग अनुरूपताओं को चित्रित करने के लिए किया जाता है। ईथेन के लिए, दो सीमा अनुरूपण संभव हैं: ग्रहणित (I) और बाधित (II)।

ब्यूटेन दो मिथाइल समूहों की उपस्थिति में ईथेन से भिन्न होता है, और इसलिए इस अणु के लिए अधिक संख्या में बाधित संरचनाएं संभव हैं, जैसा कि नीचे दिखाया गया है। I की अधिक स्थिर संरचना को इस रूप में निर्दिष्ट किया गया है विरोधी: यहां मिथाइल समूह एक दूसरे से यथासंभव दूर हैं (डायहेड्रल कोण 180 o है)। अन्य दो अनुरूपण तिरछे, या अन्यथा गौचे अनुरूपण (II और III) हैं, जिसमें मिथाइल समूह 60° का कोण बनाते हैं:

